题目内容
9.已知维生素A 的结构简式可写为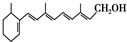 ,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )
,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )| A. | 维生素A的分子式为C20H30O | |
| B. | 维生素A中含有苯环 | |
| C. | 维生素A中可以使溴水褪色 | |
| D. | 1mol维生素A在催化剂作用下最多可与7molH2发生加成反应 |
分析 A.根据结构简式确定分子式;
B.根据图知,该物质中不含苯环但含有碳碳双键;
C.碳碳双键能和溴发生加成反应;
D.该分子中含有5个碳碳双键,只有碳碳双键能和氢气发生加成反应.
解答 解:A.根据结构简式确定分子式为C18H26O,故A错误;
B.根据图知,该物质中不含苯环但含有碳碳双键、醇羟基,故B错误;
C.维生素A中含有碳碳双键,碳碳双键能和溴发生加成反应而使溴水褪色,故C正确;
D.该分子中含有5个碳碳双键,只有碳碳双键能和氢气发生加成反应,所以1mol维生素A在催化剂作用下最多可与5molH2发生加成反应,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,易错点是分子式的确定,注意键线式中拐点和端点含有C原子,易错选项是A.

练习册系列答案
相关题目
2.短周期主族元素X、Y、Z、W、R的原子序数依次增大.X与W同主族,X、W、R原子的最外层电子数之和为14,Y原子的最外层电子数是其内层电子数的3倍,W的单质是一种重要的半导体材料,Z是同周期主族元素中原子半径最大的元素.下列说法正确的是( )
| A. | Z、W是金属元素 | |
| B. | 原子半径:r(R)<r(W)<r(Z) | |
| C. | Y与Z形成的化合物只有一种 | |
| D. | X、Z、R的最高价氧化物对应的水化物之间都能相互发生反应 |
17.可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法不正确的是( )
| A. | 以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-=4OH- | |
| B. | 以NaOH溶液为电解液时,负极反应为Al+4OH--3e-=AlO2-+2H2O | |
| C. | 以NaOH溶液为电解液时,电池在工作过程中电解液的pH增大 | |
| D. | 以NaCl溶液为电解液时,电流由空气电极沿导线流向铝合金电极 |
4.下列说法正确的是( )
| A. | CaO、H2SO4、NaHCO3、碘酒均属于化合物 | |
| B. | 胶体与溶液的本质区别在于是否产生丁达尔效应 | |
| C. | 合金具有良好的物理、化学和机械性能,熔点比成分金属低 | |
| D. | 计算机芯片、太阳能电池、石英钟表主要材料均为SiO2 |
14.元素的性质呈周期性变化的根本原因是( )
| A. | 元素的相对原子质量的递增 | |
| B. | 元素的原子半径呈周期性变化 | |
| C. | 元素原子的最外层电子排布呈周期性变化 | |
| D. | 元素的金属性和非金属性呈周期性变化 |
1.下列叙述中正确的是( )
| A. | 冰融化时水分子中共价键发生断裂 | |
| B. | H2O2、PCl5都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的酸性依次增强 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
18.下列反应中,既是离子反应,又属于有颜色变化的氧化还原反应的是( )
| A. | 硫酸铁溶液和氢氧化钠溶液混合 | B. | 钠块投人水中 | ||
| C. | HCl和 NH3反应生成NH4Cl固体 | D. | 酸性 KMnO4溶液中通人 SO2气体 |
 、GCH3CH(OH)CH2OH;
、GCH3CH(OH)CH2OH; ;②F→A
;②F→A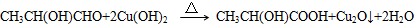 .
.