题目内容
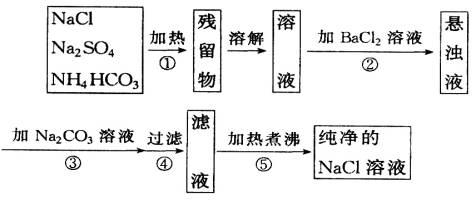
为了将混有Na2SO4、NaHCO3的NaCl提纯,并制得纯净的NaCl溶液,某学生设计了如图所示的实验方案:

(1)操作①盛放药品可选用________。(填仪器名称)
(2)操作②为什么不用Ba(NO3)2溶液,其理由是
________________________________________。
(3)进行操作②后,如何判断SO![]() 已除尽?方法是________________________________。
已除尽?方法是________________________________。
(4)操作③的目的是_______;为何不先过滤后加Na2CO3溶液,其理由是________________。
(5)此设计方案是否严密?请说明理由________________。
(1)坩埚 (2)会引入NO![]() (3)用干净的试管取上层清液,向试管中滴加BaCl2溶液,若无沉淀说明SO
(3)用干净的试管取上层清液,向试管中滴加BaCl2溶液,若无沉淀说明SO![]() 已除尽 (4)除过量的Ba2+ 可减少过滤次数 (5)不严密,在操作③时加入的Na2CO3溶液煮沸并不能除去,因此在操作④之后应加入少量盐酸,然后再加热煮沸,除去HCl?
已除尽 (4)除过量的Ba2+ 可减少过滤次数 (5)不严密,在操作③时加入的Na2CO3溶液煮沸并不能除去,因此在操作④之后应加入少量盐酸,然后再加热煮沸,除去HCl?
解析:
根据题目信息可知欲提纯NaCl,则需除去其中含有的杂质硫酸钠和碳酸氢钠,根据转化关系知①主要是使碳酸氢钠分解,②中则是除去碳酸根离子和硫酸根离子,但需要提纯NaCl,所以加入硝酸钡容易引入新的杂质离子硝酸根离子,故选用氯化钡

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目