题目内容
20.N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)?4NO2(g)+O2(g)-Q(Q>0)一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s | 0 | 500 | 1000 | 1500 |
| C(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
| A. | 500 s时O2的浓度为0.075 mol/L | |
| B. | 平衡后,升高温度,正反应速率先增大后减小 | |
| C. | 平衡后,要使平衡常数增大,改变的条件是升高温度 | |
| D. | 1000 s时将容器的体积缩小一半,重新达到平衡时0.25 mol/L<c(N2O5)<0.50 mol/L |
分析 A.计算N2O5的浓度变化量,浓度变化量之比等于化学计量数之比,据此计算氧气浓度;
B.升高温度反应速率加快,而后N2O5的浓度减小,反应速率又降低;
C.要使平衡常数增大,应改变温度使平衡正向移动,正反应为吸热反应,应升高温度;
D.1000s时反应到达平衡,平衡时c(N2O5)=0.25mol/L,其他条件不变,将容器的体积缩小一半,若平衡不移动,此时N2O5的浓度为0.5mol/L,由于体积减小,压强增大,平衡向逆反应方向移动.
解答 解:A.500s内N2O5的浓度变化量=0.5mol/L-0.35mol/L=0.15mol/L,浓度变化量之比等于化学计量数之比,故c(O2)=$\frac{1}{2}$△c(N2O5)=0.075 mol/L,故A正确;
B.升高温度反应速率加快,而后N2O5的浓度减小,反应速率又降低,故B正确;
C.要使平衡常数增大,应改变温度使平衡正向移动,正反应为吸热反应,应升高温度,故C正确;
D.1000s时反应到达平衡,平衡时c(N2O5)=0.25mol/L,其他条件不变,将容器的体积缩小一半,若平衡不移动,此时N2O5的浓度为0.5mol/L,由于体积减小,压强增大,平衡向逆反应方向移动,则达到新平衡时c(N2O5)>0.5 mol•L-1,故D错误,
故选D.
点评 本题考查化学反应速率计算、化学平衡有关计算、化学平衡影响因素等,侧重考查学生分析计算能力,难度中等,注意对基础知识的理解掌握.

练习册系列答案
 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
20.下列有关铝的化合物的说法正确的是( )
| A. | 氧化铝坩埚可用于熔融NaOH实验 | |
| B. | 氧化铝的熔点很高,是一种较好的耐火材料 | |
| C. | 明矾可用于自来水的消毒 | |
| D. | 氢氧化铝能中和胃酸,适合于胃溃疡患者服用 |
1.由两种金属组成的合金8g,投入到足量的稀硫酸中,测得产生气体5.6L(标准状况),则原合金不可能是( )
| A. | Mg-Cu合金 | B. | Mg-Fe合金 | C. | Al-Zn合金 | D. | Fe-Zn合金 |
15.在体积为1L的两个恒容密闭容器中,分别充入1molCO和1molH2O(g)的混合气体,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
(1)1100℃时,前10min该反应的化学反应速率v(CO2)=0.025mol/(L.min).
(2)计算1100℃时该反应的化学平衡常数K=$\frac{4}{9}$.
(3)能判断该反应是否达到化学平衡状态的依据是bc.
(a)容器中压强不变
(b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O)
(d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡向右移动(选填“向右”或“向左”或“不”),再达到平衡时,H2百分含量不变(选填“增大”或“减小”或“不变”).
| 0min | 10min | 20min | 30min | 40min | 50min | |
| 830℃ | 1mol | 0.8mol | 0.65mol | 0.55mol | 0.5mol | 0.5mol |
| 1100℃ | 1mol | 0.75mol | 0.6mol | 0.6mol | 0.6mol | 0.6mol |
(2)计算1100℃时该反应的化学平衡常数K=$\frac{4}{9}$.
(3)能判断该反应是否达到化学平衡状态的依据是bc.
(a)容器中压强不变
(b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O)
(d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡向右移动(选填“向右”或“向左”或“不”),再达到平衡时,H2百分含量不变(选填“增大”或“减小”或“不变”).
12.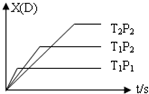 已知可逆反应 mA(g)+nB(g)?pC(g)+qD(g),反应中D的物质的量分数X(D)与时间t的关系如图,则下列叙述正确的是( )
已知可逆反应 mA(g)+nB(g)?pC(g)+qD(g),反应中D的物质的量分数X(D)与时间t的关系如图,则下列叙述正确的是( )
 已知可逆反应 mA(g)+nB(g)?pC(g)+qD(g),反应中D的物质的量分数X(D)与时间t的关系如图,则下列叙述正确的是( )
已知可逆反应 mA(g)+nB(g)?pC(g)+qD(g),反应中D的物质的量分数X(D)与时间t的关系如图,则下列叙述正确的是( )| A. | 正反应为放热反应 | B. | m+n>p+q | ||
| C. | T1<T2 | D. | P1<P2 |
9.下列各组中的化学性质比较,不正确的是( )
①酸性:HClO4>HBrO4>HIO4
②还原性:I-<Cl-<F-
③碱性:NaOH>Mg(OH)2>Al(OH)3
④稳定性:PH3>H2S>HCl
⑤半径:S2->Na+>Mg2+>O2-
⑥氧化性:Li+>Na+>K+>Rb+>Cs+.
①酸性:HClO4>HBrO4>HIO4
②还原性:I-<Cl-<F-
③碱性:NaOH>Mg(OH)2>Al(OH)3
④稳定性:PH3>H2S>HCl
⑤半径:S2->Na+>Mg2+>O2-
⑥氧化性:Li+>Na+>K+>Rb+>Cs+.
| A. | ①②④ | B. | ②④⑤ | C. | ①⑤⑥ | D. | ②③⑤ |
10.在标准状况下,进行甲、乙、丙三组镁铝合金与盐酸反应实验,三组实验的有关数据如表:
试完成下列问题:
(1)①甲组实验中,盐酸过量(填“过量”“适量”或“不足量”),理由是HCl的物质的量一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积
②乙组实验中,盐酸不足(填“过量”“适量”或“不足量”),理由是生成336mL氢气需要合金的质量为255mg×$\frac{336mL}{280mL}$=306mg<385mg
(2)求合金中镁、铝的物质的量之比,题中可作计算依据的数据是甲,求得镁、铝的物质的量之比是1:1;
(3)求HCl的物质的量.
| 组别 | 镁铝合金质量.mg | HCl物质的量/mol | 氢气的体积/mL |
| 甲 | 255 | X | 280 |
| 乙 | 385 | X | 336 |
| 丙 | 459 | X | 336 |
(1)①甲组实验中,盐酸过量(填“过量”“适量”或“不足量”),理由是HCl的物质的量一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积
②乙组实验中,盐酸不足(填“过量”“适量”或“不足量”),理由是生成336mL氢气需要合金的质量为255mg×$\frac{336mL}{280mL}$=306mg<385mg
(2)求合金中镁、铝的物质的量之比,题中可作计算依据的数据是甲,求得镁、铝的物质的量之比是1:1;
(3)求HCl的物质的量.