题目内容
【题目】下列事实不能用勒夏特列原理解释的是
A.打开汽水瓶有气泡从溶液中冒出
B.黄绿色的氯水光照后颜色变浅
C.FeCl3+3KSCN![]() Fe(SCN)3+3KCl平衡体系中加入少量铁粉,溶液颜色变浅
Fe(SCN)3+3KCl平衡体系中加入少量铁粉,溶液颜色变浅
D.2NO2(g)![]() N2O4(g)平衡体系中,加压缩小体积后颜色加深
N2O4(g)平衡体系中,加压缩小体积后颜色加深
【答案】D
【解析】
A.汽水瓶内存在反应:CO2+H2O![]() H2CO3,打开汽水瓶,瓶内压强减小,平衡逆向移动,有气体冒出,符合勒夏特列原理,A正确;
H2CO3,打开汽水瓶,瓶内压强减小,平衡逆向移动,有气体冒出,符合勒夏特列原理,A正确;
B.黄绿色的氯水中存在反应:Cl2+H2O![]() HClO+HCl, HClO光照后分解,平衡正向移动,Cl2
HClO+HCl, HClO光照后分解,平衡正向移动,Cl2![]() 减少,颜色变浅,符合勒夏特列原理,B正确;
减少,颜色变浅,符合勒夏特列原理,B正确;
C.FeCl3+3KSCN![]() Fe(SCN)3+3KCl平衡体系中加入少量铁粉,铁粉和铁离子反应,平衡逆向移动,溶液颜色变浅,符合勒夏特列原理,C正确;
Fe(SCN)3+3KCl平衡体系中加入少量铁粉,铁粉和铁离子反应,平衡逆向移动,溶液颜色变浅,符合勒夏特列原理,C正确;
D.对于反应2NO2(g)![]() N2O4(g),加压缩小体积,浓度增大,颜色加深,不符合勒夏特列原理,D错误;
N2O4(g),加压缩小体积,浓度增大,颜色加深,不符合勒夏特列原理,D错误;
答案选D。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |

(1)实验装置中,仪器c的名称为__________________,作用为__________。
(2)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了________气体,继续滴加至液溴滴完。写出a中发生反应的化学方程式:__________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用__________;
③向分出的粗溴苯中加入少量的无水氯化钙(一种干燥剂),静置、过滤。加入无水氯化钙的目的是__________________。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,需进行的操作方法为________。
【题目】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
化学式 | HF | H2CO3 | H2S |
电离平衡常数K (25℃) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
①常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最大的是____。
②将过量H2S通入Na2CO3溶液,反应的离子方程式是____。
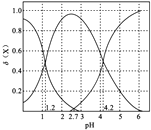
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A的电离平衡常数K1=____。
(3)室温下,用0.100 mol·L-1盐酸溶液滴定20.00 mL 0.l00 mol·L-1的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化)
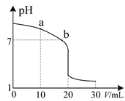
①a点所示的溶液中c(NH3·H2O)____c(Cl-)。
②b点所示的溶液中c(Cl-)____c(NH![]() )。
)。
③pH =10的氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为____。
(4)常温下,要将ZnSO4溶液中的Zn2+沉淀完全(Zn2+的浓度小于10-5 mol·L-1),应控制溶液的pH____。(已知25℃时,Ksp[Zn(OH)2] =1.0×l0-17)
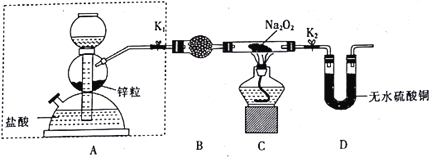
【题目】某小组探究元素周期律性质递变规律,设计如下实验。

实验I:验证碳、氮、硅元素非金属性强弱。(供选择的试剂:稀HNO3、浓H2SO4、CaCO3固体、Na2CO3固体、Na2SiO3溶液、澄清石灰水、饱和NaHCO3溶液)
(1)仪器a的名称:____。装置B所盛试剂是_____,其作用是_____;C中反应的离子方程式是_____________。
(2)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是_____。
实验II:验证同周期元素和同主族元素的金属性递变规律。(方案与现象不对应)
实验方案:①将一小块金属钠放入滴有酚酞试液的冷水中
②将一小块金属钾放入滴有酚酞试液的冷水中
③镁带与2 mol·L-1的盐酸反应
④铝条与2 mol·L-1的盐酸反应
⑤用砂纸擦后的镁带与沸水反应再向反应液中滴加酚酞
实验现象: A.浮在水面上,熔成小球,四处游动,随后消失,溶液变成红色
B.浮在水面上,熔成小球,四处游动,并伴有轻微的爆炸声,很快消失,溶液变成红色
C.产生气体,可在空气中燃烧,溶液变成浅红色
D.反应不十分剧烈,产生气体可以在空气中燃烧
E.剧烈反应,产生的气体可以在空气中燃烧
请回答:
(1)该实验中用到的玻璃仪器有____、______胶头滴管玻璃片、试管。
(2)请完成下列表格
实验方案 | 实验现象 | 化学方程式 |
① | A | 2Na +2H2O=2NaOH +H2↑ |
② | ____ | ____ |
③ | E | Mg +2HCl=MgCl2 +H2↑ |
④ | D | 2Al +6HC1=2AlCl3 +H2↑ |
⑤ | ____ | ____ |
(3)由实验得出有关元素周期律结论:_________。