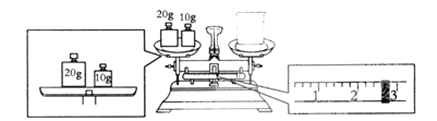
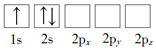
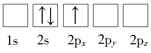
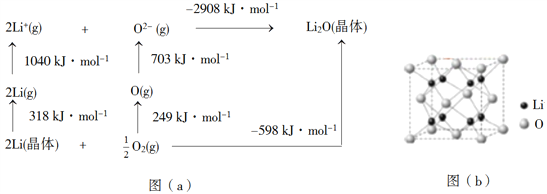
题目内容
【题目】利用下图所示联合装置制备金属钛,下列叙述错误的是( )
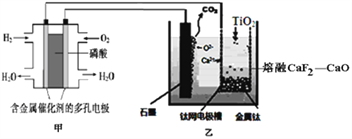
A. 甲装置工作过程中pH增大
B. 乙装置中石墨电极反应式为C-4e-+2O2-=CO2↑
C. 甲装置中通入O2的电极反应式为:O2+4e-+4H+=2H2O
D. 若不考虑装置的损失,制备24.0g金属钛,需要消耗氢气22.4L
【答案】D
【解析】根据图知,甲为燃料电池,通入氢气的电极为负极,发生氧化反应,通入氧气的电极为正极,发生还原反应;乙为电解装置,阳极上电极反应式为C+2O2--4e-═CO2↑,阴极上电极反应式为:2Ca2++4e-═2Ca,钙还原二氧化钛反应方程式为2Ca+TiO2=Ti+2CaO。A.甲装置总反应为O2+2H2═2H2O,生成水导致磷酸浓度降低,则pH增大,故A正确;B.乙装置石墨电极为阳极,电极反应式为C+2O2--4e-═CO2↑,故B正确;C.甲装置通入O2的电极为正极,反应式为O2+4H++4e-═2H2O,故C正确;D.n(Ti)= ![]() =0.5mol,则消耗1molCa,转移2mol电子,由电极方程式H2-2e-═2H+可知,需要1molH2,未注明是否为标准状况,则消耗氢气的体积不一定为22.4 L,故D错误;故选D。
=0.5mol,则消耗1molCa,转移2mol电子,由电极方程式H2-2e-═2H+可知,需要1molH2,未注明是否为标准状况,则消耗氢气的体积不一定为22.4 L,故D错误;故选D。

【题目】能源、环境与生产生活和社会发展密切相关。
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4kJ | 吸收akJ |
①下列情况能说明该反应一定达到平衡状态的是_________(填字母)。
a.v(CO2)消耗=v(CH3OH)生成 b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变 d.气体的平均相对分子质量不再随时间改变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是_________(填字母)。
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
③cl_________c2(填“>”、“<”或“=”),a=_________。
④该温度下反应的平衡常数K=_________;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=_________。
(2)已知反应:2NO2(红棕色)![]() N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是__________(填字母)。
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是__________(填字母)。
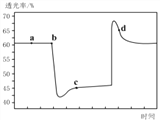
A.b点的操作是压缩注射器
B.d点:v正>v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc
【题目】常温下,下列各组物质中,Y既能与x反应又能与Z反应的是
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液 | Na2CO3 | 稀盐酸 |
③ | CO2 | Na2O2 | H2O |
④ | AgNO3溶液 | Cu | 稀硫酸 |
A. ①④ B. ②③ C. ②④ D. ①③