题目内容
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素。A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式__________;F离子电子排布式为__________。
(2)写出X的化学式__________________________,化学名称为_________________。
(3)写出X涉及金属冶炼中的一个化学方程式_______________________________。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:
________________________________________________________________________。
(5)CE、FA的晶格能分别为786 kJ·mol-1、3 401 kJ·mol-1,试分析导致两者晶格能差异的主要原因是_______________________________________
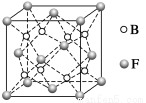
(6)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________________(只要求列出算式)。
(1)2s22p4 1s22s22p63s23p6
(2)Na3AlF6 六氟合铝酸钠
(3)2Al2O3(熔融)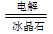 4Al+3O2↑
4Al+3O2↑
(4)Al2O3为离子晶体而AlCl3为分子晶体,熔融状态下AlCl3不导电
(5)CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量
(6)CaF2 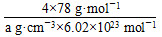
【解析】由A原子L层上有2对成对电子,可知A原子的电子排布为1s22s22p4,为氧元素;A与B同周期,且B原子序数大于A的,故B必为氟元素;则可根据C3DB6为离子晶体,且B、C、D的简单离子核外电子排布相同,结合化合价可推出C、D分别为钠元素和铝元素,X为Na3AlF6;由CE、FA为电子数相同的离子晶体可推出二者分别为NaCl和CaO。(6)由图中看出,每个晶胞中含有Ca原子个数8×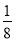 +6×
+6×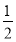 =4,F原子全部在该晶胞内部,故该晶胞含有F原子个数为8,其化学式为CaF2;取一个晶胞,其质量为
=4,F原子全部在该晶胞内部,故该晶胞含有F原子个数为8,其化学式为CaF2;取一个晶胞,其质量为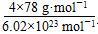 ,则其体积为质量除以密度,即
,则其体积为质量除以密度,即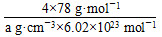 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒,存在于多种生产过程以及自然界中。在人体的很多生理过程中也起着重要作用。
资料:①H2S可溶于水?约1∶2?,其水溶液为二元弱酸。
②H2S可与许多金属离子反应生成沉淀。
③H2S在空气中燃烧,火焰呈淡蓝色。
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示。A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液。
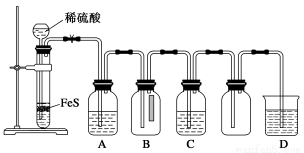
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为___________________。
②B中的现象是__________________。
③C中只有浅黄色沉淀产生,且溶液变浅绿色。则C中发生反应的离子方程式为______________。
④D中盛放的试剂可以是________(填字母序号)。
a.水 b.盐酸
c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小明同学又设计了下列实验。
| 实验操作 | 实验现象 |
实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
已知:电离平衡常数:
H2S Kal=1.3×10-7,Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2,Ka2=5.6×10-8
①根据上述实验,可以得出结论:在__________条件下,+4价硫化合物可以氧化-2价硫的化合物。
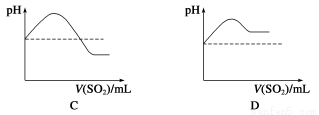
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是________(填字母序号)。

(3)文献记载,常温下H2S可与Ag发生置换反应生成H2。现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应______。