题目内容
在体积为VmL、密度为dg·cm-3的溶液中,溶有式量为M的溶质mg,其物质的量浓度为cmol·L-1,质量分数为w%,则下列表示式中正确的是
A.c=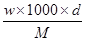 | B.m=Vd |
C.w%= | D.c= |
B
根据 可知,A、C不正确。D中应该是
可知,A、C不正确。D中应该是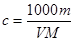 ,所以正确的答案选B。
,所以正确的答案选B。
 可知,A、C不正确。D中应该是
可知,A、C不正确。D中应该是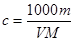 ,所以正确的答案选B。
,所以正确的答案选B。
练习册系列答案
相关题目
题目内容
A.c=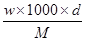 | B.m=Vd |
C.w%= | D.c= |
 可知,A、C不正确。D中应该是
可知,A、C不正确。D中应该是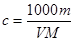 ,所以正确的答案选B。
,所以正确的答案选B。