题目内容
9.用下列方法均可制得氧气:若要制得相同质量的氧气,反应中电子转移数目之比为( )①2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑
②2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑
③2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
| A. | 3?1?1 | B. | 3?1?4 | C. | 1?1?1 | D. | 2?1?1 |
分析 ①2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑
②2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑
③2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑制得相同质量的氧气,即氧气的物质的量相等,反应中均是-2价O被氧化变成0价,故由得失电子守恒得知,转移电子数目相等.
解答 解:由此三个反应特点得知:制得相同质量的氧气,即氧气的物质的量相等,反应中均是-2价O被氧化变成0价,故由得失电子守恒得知,转移电子数目相等,故答案为:C.
点评 本题考查氧化还原反应的计算,为高频考点,侧重氧化还原反应电子转移的考查,注意电子守恒的应用,明确反应中元素的化合价变化即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列说法不正确的是( )
| A. | 不慎碰倒酒精灯,洒出的酒精在桌面上燃烧,应立即用湿抹布盖灭 | |
| B. | 眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉眼睛 | |
| C. | 万一发生着火,要沉着快速处理,首先要切断热源、电源,移走附近的可燃物,再针对燃烧物的性质选用湿抹布、干沙土、水、泡沫灭火器、二氧化碳灭火器、1211灭火器等来进行灭火 | |
| D. | 给试管里的液体加热时,液体的体积不超过其容积的2/3 |
4.设NA为阿佛加德罗常,下列叙述正确的是( )
| A. | 在100mL0.5mol/LCH3COOH溶液中CH3COOH分子数等于0.05NA | |
| B. | 在标况下,22.4L辛烷含共价键数为25NA | |
| C. | 已知PbI2的KSP=7.0×10-9,将1.0×10-2mol/L的KI与Pb(NO3)2溶液等体积混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为5.6×10-4 mol/L | |
| D. | 25℃时,1LpH=13的Ba(OH)2溶液中含有OH-数目为0.2NA |
14.下列关于硅单质及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素
②玻璃、陶瓷、水泥三大工艺的共同点是都以硅酸盐为原料生产原料
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料.
①硅是构成一些岩石和矿物的基本元素
②玻璃、陶瓷、水泥三大工艺的共同点是都以硅酸盐为原料生产原料
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料.
| A. | ①② | B. | ②③ | C. | ①④ | D. | ①②④ |
1.相同温度的下列溶液:①0.1mol•L-1的硫酸 ②0.01mol•L-1的NaOH溶液,其中由水电离产生的[H+]之比为( )
| A. | 1:1 | B. | 1:10 | C. | 1:20 | D. | 20:1 |
18.下列说法不正确的是( )
| A. | 1mol氧原子 | B. | 1mol 氢分子 | C. | 1mol 苹果 | D. | 1mol水 |
19.下列各项中,与元素化学性质关系最密切的是原子的( )
| A. | 核外电子层数 | B. | 最外层电子数 | C. | 核内中子数 | D. | 相对原子质量 |
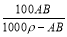 g
g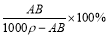 g
g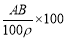 g
g
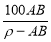 g
g