题目内容
9.下列操作不能达到目的是( )| 选项 | 目的 | 操作 |
| A. | 配制100 mL 1.0 mol•L-1 CuSO4溶液 | 将25 g CuSO4•5H2O溶于100 mL蒸馏水中 |
| B. | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C. | 提取溴水中的Br2 | 向溶液中加入乙醇后振荡,静置,分液 |
| D. | 溶液中是否含有K+ | 焰色反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.水的体积不等于溶液的体积;
B.硝酸钾和氯化钠的溶解度随温度的变化不同,可用重结晶法分离;
C.乙醇易溶于水,不能用于萃取剂;
D.K的焰色反应成紫色,可用于鉴别.
解答 解:A.水的体积不等于溶液的体积,应加水至溶液的体积等于100mL,故A错误;
B.硝酸钾和氯化钠的溶解度随温度的变化不同,可用重结晶法分离,故B正确;
C.乙醇易溶于水,不能用于萃取剂,可用苯或四氯化碳分离,故C错误;
D.K的焰色反应成紫色,可用于鉴别,注意鉴别时通过蓝色钴玻璃观察,故D正确.
故选AC.
点评 本题考查化学实验方案的评价,涉及物质的分离、检验和溶液的配制等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握物质的性质的异同以及实验的合理性和可行性的评价,难度不大.

练习册系列答案
相关题目
19.CoCl2•xH2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种新工艺流程如图:
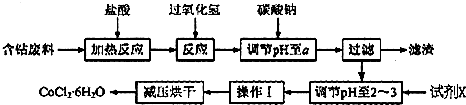
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl═CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)写出加入过氧化氢时溶液中发生的离子反应方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
(2)加入碳酸钠调节pH至a,a的范围是5.2~7.6;
(3)最合适的试剂X是盐酸
(4)操作I包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和减压过滤.
(5)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl═CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Co(OH)3 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.2 | 5.2 |
(1)写出加入过氧化氢时溶液中发生的离子反应方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
(2)加入碳酸钠调节pH至a,a的范围是5.2~7.6;
(3)最合适的试剂X是盐酸
(4)操作I包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和减压过滤.
(5)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
20.有机化合物M的结构简式如图所示,有关化合物M的叙述正确的是( )
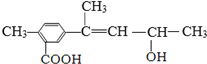
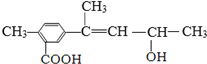
| A. | M的分子式为C13H18O3 | |
| B. | M一定条件下,可以发生加成、酯化、水解等反应 | |
| C. | 1mol M与足量金属钠反应,可生成标准状况下的H211.2 L | |
| D. | 1mol M最多能与4mol H2发生加成反应 |
17.在容积一定的密闭窗口中,反应A?B(g)+C(s)达平衡,若继续升高温度,容器内气体的密度增大,下列判断正确的是( )
| A. | 压强对该反应的平衡移动没有影响 | |
| B. | 在平衡体系中加入C,混合气体平均分子量增大 | |
| C. | 若正反应为吸热反应,则A为非气态 | |
| D. | 若正反应为放热反应,则A为非气态 |
4.在一定条件下恒容的密闭容器中,可逆反应:2NO+O2?2NO2一定条件下,达到平衡的标志是( )
| A. | 混合气体的颜色不再变化 | |
| B. | NO、O2、NO2的分子个数之比为2:1:2 | |
| C. | 反应混合物中各组分的物质的量浓度相等 | |
| D. | 混合气体的平均相对分子质量不变 |
14.下列说法不正确的是( )
| A. | 分散质粒子的直径在10-9~10-7m之间的分散系叫做胶体 | |
| B. | KAl(SO4)2在水溶液中电离方程式为KAl(SO4)2═K++Al3++2SO42- | |
| C. | 利用丁达尔效应可以鉴别CuSO4溶液和氢氧化铁胶体 | |
| D. | 在FeCl3溶液中滴加NaOH溶液可得氢氧化铁胶体 |
 与Br2发生加成反应,生成的产物中可能含有下列的( )
与Br2发生加成反应,生成的产物中可能含有下列的( )