题目内容
【题目】X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为54。X的激发态原子电子排布式为2p1,Y原子的基态原子有3个不同的能级,且各能级中电子数相等,Z的基态原子中有3个未成对电子,W的电离能如下表所示,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态。
元素 | 第一电离能 | 第二电离能 | 第三电离能 |
W | 495.8 | 4562 | 6910.3 |
(1)U原子电子排布式为_______________。
(2)X与Z 形成的化合物Z2X4,Z原子采取的杂化轨道类型为_______,Y的最高价氧化物的水化物的正盐的阴离子的空间构型为_______;
(3)W的氯化物和Mg的氯化物中,熔点较高的是________(填化学式),原因是_______。
(4)I4O9由一种阳离子和一种阴离子按物质的量比1:3构成,阴离子的空间构型为三角锥形,中心原子杂化类型为sp3杂化,写出I4O9的电离方程式______。
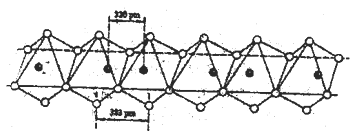
(5)Nb(黑球)和I(白球)能形成一种线性的无机高分子化合物,其结构是许多八面体通过棱边而联结起来的长链,如下图所示。则该化合物中Nb和I的原子个数比为______。
【答案】 1s22s22p63s23p63d104s1 sp3 平面三角形 MgCl2 NaCl和MgCl2都为离子晶体,Mg2+半径小,电荷数大,因此MgCl2晶体的晶格能大,熔点高 I4O9=I3++3IO3- 1:4
【解析】X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为54。X的激发态原子电子排布式为2p1,X是H;Y原子的基态原子有3个不同的能级,且各能级中电子数相等,Y是C;Z的基态原子中有3个未成对电子,Z是N;W的第二电离能远大于第一电离能,所以W是第ⅠA元素,W是Na,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态,所以U是铜。则
(1)铜的原子序数是29,原子电子排布式为1s22s22p63s23p63d104s1。(2)X与Z形成的化合物N2H4的分子中N原子的价层电子对数是4,含有一对孤对电子,则N原子采取的杂化轨道类型为sp3;C的最高价氧化物的水化物的正盐的阴离子CO32-中C原子的价层电子对数是3,不存在孤对电子,其空间构型为平面三角形;(3)由于NaCl和MgCl2都为离子晶体,Mg2+半径小,电荷数大,因此MgCl2晶体的晶格能大,熔点高;(4)I4O9由一种阳离子和一种阴离子按物质的量比1:3构成,阴离子的空间构型为三角锥形,中心原子杂化类型为sp3杂化,所以阴离子是IO3-,则阳离子是I3+,因此I4O9的电离方程式为I4O9=I3++3IO3-。(5)根据晶胞结构可知一个正八面体中含有1个Nb,I原子个数是2+4×1/2=4,所以该化合物中Nb和I的原子个数比为1:4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案