题目内容
(2009?长春一模)下表的实线表示元素周期表的部分边界,①-⑥分别表示元素周期表中对应位置的元素.
(1)在上表中用实线补全元素周期表边界
(2)元素②的氢化物电子式为:
 .
.
(3)元素④的氢化物在CCl4中溶解度比在水中的溶解度
(4)元素⑤的单质,元素⑥的单质和⑤⑥形成的合金,这三种物质中,熔点最低的是
A.元素⑤的单质 B.元素⑥的单质 C.⑤⑥形成的合金 D.无法判断
(5)由元素①的最简单的氢化物,元素③的单质和KOH溶液组成的新型燃料电池中,负极上发生的反应的电极反应式为:
| ① | ② | ③ | ④ | ||||||||||||||
| ⑤ | |||||||||||||||||
| ⑥ | |||||||||||||||||
(2)元素②的氢化物电子式为:


(3)元素④的氢化物在CCl4中溶解度比在水中的溶解度
小
小
(填“大”或“小”).(4)元素⑤的单质,元素⑥的单质和⑤⑥形成的合金,这三种物质中,熔点最低的是
C
C
.A.元素⑤的单质 B.元素⑥的单质 C.⑤⑥形成的合金 D.无法判断
(5)由元素①的最简单的氢化物,元素③的单质和KOH溶液组成的新型燃料电池中,负极上发生的反应的电极反应式为:
CH4-8e-+10OH-═CO32-+7H2O
CH4-8e-+10OH-═CO32-+7H2O
.分析:(1)根据一、二、三周期为短周期,第七周期为不完全周期来补全元素周期表边界;
(2)②为N,则氢化物为氨气,由最外层电子来分析电子式;
(3)④为F,氢化物为HF,根据相似相溶原理来分析溶解性;
(4)⑤为Na,⑥为K,合金的熔点比各组成金属的熔点都低;
(5)①为C,最简单的氢化物为甲烷,③为O,则构成甲烷、氧气的碱性燃料电池,负极上甲烷失去电子发生氧化反应.
(2)②为N,则氢化物为氨气,由最外层电子来分析电子式;
(3)④为F,氢化物为HF,根据相似相溶原理来分析溶解性;
(4)⑤为Na,⑥为K,合金的熔点比各组成金属的熔点都低;
(5)①为C,最简单的氢化物为甲烷,③为O,则构成甲烷、氧气的碱性燃料电池,负极上甲烷失去电子发生氧化反应.
解答:解:(1)一、二、三周期为短周期,第七周期为不完全周期,元素周期表中的3~13为过渡元素,则边界为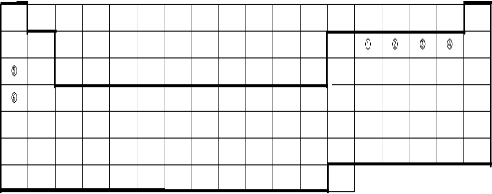 ,
,
故答案为: ;
;
(2)②为N,则氢化物为氨气,N原子最外层有5个电子,则氨气的电子式为 ,故答案为:
,故答案为: ;
;
(3)④为F,氢化物为HF,为极性分子,水为极性分子,而CCl4为非极性分子,由相似相溶原理可知,HF在CCl4中溶解度比在水中的溶解度小,故答案为:小;
(4)⑤为Na,⑥为K,合金的熔点比各组成金属的熔点都低,则三种物质中,熔点最低的是合金,故答案为:C;
(5)①为C,最简单的氢化物为甲烷,③为O,则构成甲烷、氧气的碱性燃料电池,负极上甲烷失去电子发生氧化反应,则负极反应为CH4-8e-+10OH-═CO32-+7H2O,
故答案为:CH4-8e-+10OH-═CO32-+7H2O.
 ,
,故答案为:
 ;
;(2)②为N,则氢化物为氨气,N原子最外层有5个电子,则氨气的电子式为
 ,故答案为:
,故答案为: ;
;(3)④为F,氢化物为HF,为极性分子,水为极性分子,而CCl4为非极性分子,由相似相溶原理可知,HF在CCl4中溶解度比在水中的溶解度小,故答案为:小;
(4)⑤为Na,⑥为K,合金的熔点比各组成金属的熔点都低,则三种物质中,熔点最低的是合金,故答案为:C;
(5)①为C,最简单的氢化物为甲烷,③为O,则构成甲烷、氧气的碱性燃料电池,负极上甲烷失去电子发生氧化反应,则负极反应为CH4-8e-+10OH-═CO32-+7H2O,
故答案为:CH4-8e-+10OH-═CO32-+7H2O.
点评:本题考查元素周期表、合金的性质、物质的溶解性、原电池等,考查知识点较多,综合性较强,但难度不大,注重基础知识的考查.

练习册系列答案
相关题目