题目内容
【题目】某化学学习小组采用下列装置,对浓硫酸与木炭的反应进行探究。

请回答下列问题:
(1)检查装置气密性后,将燃料匙中的木炭在酒精灯上加热至红热状态,立即伸入三颈瓶中,并塞紧瓶塞,滴加浓硝酸,可观察到三颈瓶中气体的颜色为________,产生该气体的化学反应方程式是___________。
(2)装置C中盛有足量Ba(OH)2溶液,反应一段时间后可观察到C中出现白色沉淀,该白色沉淀为_______(写化学式)。
(3)装置B的作用是________________________。
(4)装置D中收集到了无色气体,部分同学认为是NO,还有部分同学认为是O2。(假设装置内空气已排净,D瓶中收集的气体仅为产物)。
①下列对该气体的检验方法合适的是________(填序号)。
A. 敞口观察集气瓶内气体的颜色变化
B. 将润湿的蓝色石蕊试纸伸入集气瓶内,观察试纸是否变红
C. 将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果集气瓶中收集到的无色气体是氧气,则氧气的来源是___。(用相关化学方程式表示)。
(5)若将木炭改为铜片,再用等质量的铜片分别与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。针对此现象,同学们进行讨论,提出两种意见:①认为两溶液所显颜色不同是由Cu2+浓度的差异引起的。②认为前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。
你认为上述意见________ (填“①”或“②”)合理。请设计一个简单的实验进行验证:____。
【答案】 红棕色 C+4HNO3(浓) ![]() 4NO2↑+CO2↑+2H2O BaCO3 防倒吸 AC 4HNO3
4NO2↑+CO2↑+2H2O BaCO3 防倒吸 AC 4HNO3![]() 4NO2↑ + O2↑ + 2H2O ② 向显蓝色的Cu(NO3)2溶液中通入NO2(或其他合理答案)
4NO2↑ + O2↑ + 2H2O ② 向显蓝色的Cu(NO3)2溶液中通入NO2(或其他合理答案)
【解析】(1)装置A中发生的是浓硝酸与木炭的反应,生成NO2、CO2、H2O,由于NO2为红棕色气体,故三颈瓶中的气体为红棕色;产生该气体的化学反应方程式是:C+4HNO3(浓) ![]() 4NO2↑+CO2↑+2H2O; (2)将NO2、CO2通入Ba(OH)2溶液中分别生成Ba(NO3)2和BaCO3,由于Ba(OH)2溶液足量,故溶液为碱性环境,BaCO3不溶解以沉淀形式析出,白色沉淀为BaCO3; (3)装置B可以防止装置C中酸性气体因溶解速率太快而出现倒吸;(4)①A、NO与足量O2反应生成红棕色的NO2,选项A正确;B、NO和O2均不具有酸性,不能用润湿的蓝色石蕊试纸进行检验,选项B错误;C、O2能使带火星的木条复燃,而NO不能,选项C正确。答案选AC;②装置A中除发生木炭与浓硝酸的反应外,还发生浓硝酸的分解反应,则氧气的来源是4HNO3
4NO2↑+CO2↑+2H2O; (2)将NO2、CO2通入Ba(OH)2溶液中分别生成Ba(NO3)2和BaCO3,由于Ba(OH)2溶液足量,故溶液为碱性环境,BaCO3不溶解以沉淀形式析出,白色沉淀为BaCO3; (3)装置B可以防止装置C中酸性气体因溶解速率太快而出现倒吸;(4)①A、NO与足量O2反应生成红棕色的NO2,选项A正确;B、NO和O2均不具有酸性,不能用润湿的蓝色石蕊试纸进行检验,选项B错误;C、O2能使带火星的木条复燃,而NO不能,选项C正确。答案选AC;②装置A中除发生木炭与浓硝酸的反应外,还发生浓硝酸的分解反应,则氧气的来源是4HNO3![]() 4NO2↑ + O2↑ + 2H2O;(5)因Cu的质量相等,且浓、稀HNO3均过量,Cu完全反应生成的Cu(NO3)2的浓度相等,溶液中的c(Cu2+)是一样的,①不合理,②合理。既然②是由红棕色NO2溶于溶液中引起的,只要将NO2除去或者在Cu与稀HNO3反应后向显蓝色的Cu(NO3)2溶液的反应器中通入NO2即可验证。
4NO2↑ + O2↑ + 2H2O;(5)因Cu的质量相等,且浓、稀HNO3均过量,Cu完全反应生成的Cu(NO3)2的浓度相等,溶液中的c(Cu2+)是一样的,①不合理,②合理。既然②是由红棕色NO2溶于溶液中引起的,只要将NO2除去或者在Cu与稀HNO3反应后向显蓝色的Cu(NO3)2溶液的反应器中通入NO2即可验证。

【题目】(1)下列各组分子中,属于含极性键的非极性分子的是 _______________
BF3 、 H2S 、 CH3Cl 、 NH3 、 CS2、 C60、 C2H4 、 HCl
(2)按所示格式填写下表中的空格:
原子序数 | 原子的价电子排布式 | 周期 | 族 |
17 | ①______ | 第三 | ②______ |
③______ | 3d54s1 | ④______ | ⅥB |
(3)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是______,配离子 [Cu(NH3)4]2+中提供孤对电子的原子是_______________。
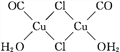
(4)镍的羰基配合物Ni(CO)4是获得高纯度纳米镍的原料,该配合物中镍原子的的价电子排布式为3d10,则其杂化轨道类型为____,Ni(CO)4是_____(填“极性”或“非极性”)分子。
(5)氯化亚铜是一种白色固体,实验测得其蒸气密度是同条件下氢气密度的99.5倍,则氯化亚铜的分子式为____;氯化亚铜的盐酸溶液可定量吸收CO形成配合物Cu2(CO)2Cl2·2H2O(结构如图所示),该反应可用于测定空气中CO的含量,每个Cu2(CO)2Cl2·2H2O分子中含有____个配位键,____个σ键。