题目内容
【题目】A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红。
(1)F的三种核素表示符号为______,E的名称为______,D的最高价氧化物的水化物的电子式:______。
(2)在B、C、D、E、F原子形成的单核离子中离子半径最小的是____,离子半径最大的是____。(填离子符号)
(3)A、B、C的氢化物稳定性顺序为_____(用分子式表示);B的氢化物和B的最高价氧化物的水化物反应生成Z,反应中断裂化学键是_____,形成的化学键是________。(填“离子键”、“极性键”、“非极性键”、“氢键”)
(4)F2C和F2E中,沸点较高的是__________(填化学式),其主要原因是_________。
(5)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为________。
【答案】 1H2H3H 硫 ![]() H+ S2- H2O>NH3>CH4 极性键 极性键和离子键 H2O H2S分子间只存在分子间作用力,而H2O分子间还存在比分子间作用力强的氢键。 H++HSO3-=SO2+H2O
H+ S2- H2O>NH3>CH4 极性键 极性键和离子键 H2O H2S分子间只存在分子间作用力,而H2O分子间还存在比分子间作用力强的氢键。 H++HSO3-=SO2+H2O
【解析】本题考查元素周期表的“位构性”的应用,F元素的原子在周期表中半径最小,即F为H,常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红,溶液变红说明产生碱,即D2C2为Na2O2,C元素为O,D为Na,C与E属于同主族元素,则E为S,A与C最外层电子数之比为2:3,则A的最外层电子数为4,即为C或Si,B的最外层电子数比C的最外层电子数少1个,即B为N或P,因为A与B、B与C相邻,则A为C,B为N,(1)H在自然界有三种核素,即氕、氘、氚,表示符号是1H、2H、3H;根据上述推断E为S,名称为硫;D的最高价氧化物的水化物是NaOH,其电子式为![]() ;(2)形成的简单离子分别是N3-、O2-、Na+、S2-、H+,电子层数越小,半径越小,因此离子半径最小的是H+,S2-的电子层数最多,则S2-半径最大;(3)氢化物分别是CH4、NH3、H2O,同周期从左向右非金属性增强,其氢化物的稳定性增强,即稳定性的顺序是H2O>NH3>CH4;B的氢化物是NH3,B的最高价氧化物的水化物是HNO3,两者反应:NH3+HNO3=NH4NO3,NH3和HNO3都是共价化合物,断裂的是极性键,NH4NO3属于离子化合物,形成的化学键是离子键和极性键;(4)H2O和H2S,水分子间存在分子间氢键,H 2S分子间不存分子间氢键,存在分子间氢键的物质的熔沸点比没有分子间氢键物质的熔沸点高;(5)组成的物质是NaHSO4和NaHSO3,离子方程式为HSO3-+H+=H2O+SO2↑。
;(2)形成的简单离子分别是N3-、O2-、Na+、S2-、H+,电子层数越小,半径越小,因此离子半径最小的是H+,S2-的电子层数最多,则S2-半径最大;(3)氢化物分别是CH4、NH3、H2O,同周期从左向右非金属性增强,其氢化物的稳定性增强,即稳定性的顺序是H2O>NH3>CH4;B的氢化物是NH3,B的最高价氧化物的水化物是HNO3,两者反应:NH3+HNO3=NH4NO3,NH3和HNO3都是共价化合物,断裂的是极性键,NH4NO3属于离子化合物,形成的化学键是离子键和极性键;(4)H2O和H2S,水分子间存在分子间氢键,H 2S分子间不存分子间氢键,存在分子间氢键的物质的熔沸点比没有分子间氢键物质的熔沸点高;(5)组成的物质是NaHSO4和NaHSO3,离子方程式为HSO3-+H+=H2O+SO2↑。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
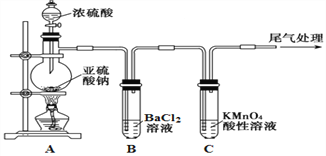
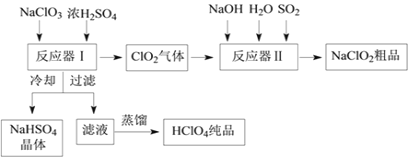
名题训练系列答案【题目】氯酸钾是一种强氧化剂,在不同条件下KClO3将KI氧化为I2或KIO3。某实验小组在实验室中对KClO3和KI的反应进行了探究。回答下列问题:
实验一 制取氯酸钾
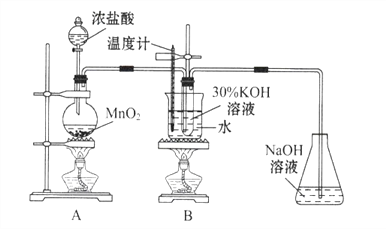
(1)A中反应的化学方程式为_______。实验开始时,首先进行的实验步骤是________。
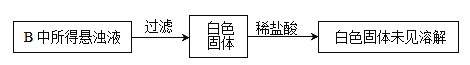
(2)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤.该实验操作过程需要的玻璃仪器有_______.
(3)A和B装置之间缺少除去氯气中氯化氢的装置,是否会对实验结果产生不利影响,其理由是_________(填“是”或“否”,若选择“是”请说明理由,若选择“否”则不需说明理由)
实验二 氯酸钾与碘化钾反应的研究
(4)该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL﹣1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL﹣1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是__.
②设计1号试管实验的作用是__.
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl