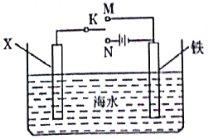
��Ŀ����
����Ŀ��ij�л���A����NaOH��Һ��Ӧ��������к��б�������Է�������Ϊ136�����к�̼����������Ϊ70��6%�������������Ϊ5��9%������Ϊ����
��1��A�ķ���ʽ��_________��
��A����NaHCO3��Һ��Ӧ�ų�CO2���壬��ṹ��_____�֡�
��3����A��NaOH��Һ�ڼ���ʱ���ܷ�Ӧ����1mol A����1mol NaOH����A�Ľṹ��ʽ������___________________������_______________________��
��4����A��NaOH��Һ�ڼ���ʱ���ܷ�Ӧ����1mol A����2mol NaOH�������������A�Ľṹ������____�֣������ܷ���������Ӧ����____�֣����ܷ���������Ӧ�����ʵĽṹ��ʽ��_______��
���𰸡�C8H8O2 4 ![]()
![]() 4 3
4 3 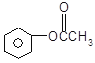
��������
��1�����A��N��C��=![]() =8��N��H��=
=8��N��H��=![]() =8��N��O��=
=8��N��O��=![]() =2���ʷ���ʽΪC8H8O2 ����ΪC8H8O2 ��
=2���ʷ���ʽΪC8H8O2 ����ΪC8H8O2 ��
��2�������˱�������Ϊ���ͼ�������ԭ��������2n-6=2��8-6=10����������ֻ��8����ԭ�ӣ��ʲ�����һ�������ͼ���A����̼�����Ʒ�Ӧ�ų�������̼��������к����Ȼ�����Ϊ�����ᡢ��������ȣ����м����������ڡ��䡢��3�֣���4�֣��ʴ�Ϊ4��
��3����A��NaOH��Һ�ڼ���ʱ���ܷ�Ӧ����1mol A����1mol NaOH��˵�������к�����������Ϊ�������������ᱽ�����ȣ��ṹ��ʽΪ![]() ��
��
�ʴ�Ϊ![]() ��
��
��4����A��NaOH��Һ�ڼ���ʱ���ܷ�Ӧ����1mol A����2mol NaOH����Ӧ��ͬ���칹����ɼ���ͼ������γɵļ��ᱽ���������м����������ڡ��䡢��3�֣���һ��Ϊ���ᱽ���������ܷ���������Ӧ���ṹ��ʽΪ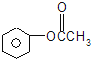 ���ʴ�Ϊ4��3��
���ʴ�Ϊ4��3�� ��
��

 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
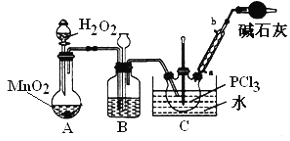
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�����Ŀ��POCl3�������뵼����Ӽ������άԭ�ϣ�ʵ�����Ʊ�POCl3���ⶨ��Ʒ������ʵ��������£�
I���Ʊ�PCl3
��1��ʵ�����ø�����غ�Ũ���ᷴӦ������������װ�ÿ�����ͼ�е�____������ĸ���ţ���
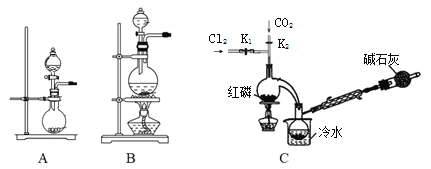
��2�����װ��C�����Բ�װ��ҩƷ���ȹر�K1����K2ͨ������CO2��һ��ʱ��ر�K2����������ƿͬʱ��K1ͨ�������������Ӧ�������С�ͼ�м�ʯ�ҵ�������______________��
II��ʵ�����Ʊ�POCl3��
������������Һ̬PCl3����ȡPOCl3��ʵ��װ�ã����ȼ��г������ԣ���ͼ��
���ϣ���Ag++SCN����AgSCN����Ksp��AgCl����Ksp��AgSCN����
��PCl3��POCl3�������Ϣ���±���
���� | �۵�/�� | �е�/�� | ��Է������� | ���� |
PCl3 | ��112.0 | 76.0 | 137.5 | �����ܣ���Ϊ��ɫҺ�壬��ˮ�����ҷ�Ӧ���ɺ�������Ȼ��� |
POCl3 | 2.0 | 106.0 | 153.5 |
��3��POCl3�ڳ�ʪ�����л���ҡ����̡�����Ӧ�Ļ�ѧ����ʽΪ___________________________________��
��4����Ӧ�¶�Ҫ������60��65�棬ԭ���ǣ�_________________________________��
��5��ͨ��������·����Բⶨ��Ʒ��ClԪ�غ�����ʵ�鲽�����£�
a��ȷ��ȡ15.0 g POCl3��Ʒ������ʢ��60.00 mL����ˮ��ˮ��ƿ��ҡ������ȫˮ�⣬��ˮ��Һ���100.00 mL��Һ��
b��ȡ10.00 mL��Һ����ƿ�У�����10.00 mL 3.2 molL��1 AgNO3����Һ��
c��������������������ҡ����ʹ�������汻�л��︲�ǡ�
d����NH4Fe (SO4) 2Ϊָʾ������0.2 molL��1 NH4SCN��Һ�ζ�������AgNO3��Һ���ﵽ�ζ��յ�ʱ����ȥl0.00 mL NH4SCN��Һ��
�ٲ���d�дﵽ�ζ��յ��������__________________________________________��
�ڲ�Ʒ��ClԪ�ص���������Ϊ______________������3λ��Ч���֣���
����Ŀ���о�CO2��CH4��Ӧʹ֮ת��ΪCO��H2���Լ���ȼ��Σ���ͼ�������ЧӦ������Ҫ�����塣��ҵ��CO2��CH4������ӦI��CH4(g)+CO2(g)��2CO(g)+2H2(g) ��H1
�ڷ�Ӧ�����л�������Ӧ����H2(g)+CO2(g)��H2O(g)+CO(g)��H2=+41kJ/mol
(l)��֪���ֻ�ѧ���ļ����������±���ʾ��
��ѧ�� | C��H | H��H | C=O |
|
���ܣ�kJ/mol�� | 413 | 436 | 803 | 1076 |
����Hl =____kJ/mol����Ӧ����һ���������ܹ��Է����е�ԭ����____���÷�Ӧ��ҵ�������˵��¶Ⱥ�ѹǿΪ____�����ţ���
A.���¸�ѹ B�����µ�ѹ C�����¸�ѹ D�����µ�ѹ
(2)��ҵ�Ͻ�CH4��CO2�����ʵ���1:1Ͷ����ȡCO2��H2ʱ��CH4��CO2��ƽ��ת�������¶ȱ仯��ϵ��ͼ��ʾ��
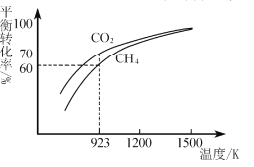
��923KʱCO2��ƽ��ת���ʴ���CH4��ԭ����________________________
�ڼ���923Kʱ��ӦII�Ļ�ѧƽ�ⳣ��K=______������������С�������λ����
��1200K����CO2��CH4��ƽ��ת����������ȵ�ԭ�������____��
(3)��ҵ��CH4��CO2��Ӧʱͨ�������O2������Ӧ
III: CH4+2O2��CO2+2H2O������O2��������Ӧ�����Ļ�̼�ͼ�С��Ӧ�����ȸ��ɣ���λʱ����ά�ַ�Ӧ�������蹩������������O2�Ľ������뷴Ӧ���ȸ��ɵĹ�ϵ��ͼ��ʾ��
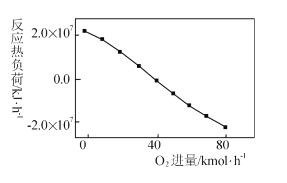
������O2�����������ӣ��ȸ����½���ԭ���� ____��
�ڲ���O2��ʹCH4��ƽ��ת����____������������������С����������������ͬ����CO2��ƽ��ת����________