题目内容
 实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后退色的原因.
实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后退色的原因.【分析与猜想】
(1)根据过氧化钠与水反应的原理:2Na2O2+2H2O═4NaOH+O2↑,往过氧化钠固体完全溶解反应后的溶液中滴加酚酞本应只会变红而不会退色,而实验中发现酚酞变红后又退色.由此提出如下的猜想:
A.氧气有漂白性
B.氢氧化钠有漂白性
C.
【实验与判断】
请完成表格:
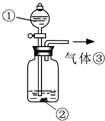
| 实验编号 | 1 | 2 | 3 |
| 实验装置 | 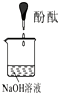 |
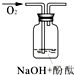 |
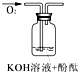 |
| 验证猜想 | C | ||
| 实验现象 | 溶液变红后不退色 | ||
| 实验说明 | 1、2的实验中NaOH溶液是用 | ||
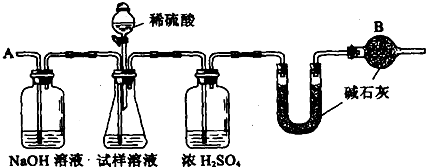
(3)可用如图装置对溶液中不很稳定的物质进行探究,在①处装入的物质是
A.酚酞试剂
B.过氧化钠与水反应后的溶液
C.二氧化锰
D.氢氧化钠固体配制的溶液
(4)气体③是
分析:(1)根据反应方程式2Na2O2+2H2O═4NaOH+O2↑可知,反应产物有两种:氢氧化钠和氧气,褪色的原因只能是氢氧化钠、氧气或者二者共同作用;实验1、2、3的实验装置、加入的试剂进行判断对应的猜想序号;无论避免干扰,氢氧化钠溶液必须使用氢氧化钠固体配制;
(2)钠元素形成了稳定的化合物,则另一种不稳定的、具有漂白性的物质只能为具有强氧化性的双氧水;
(3)根据双氧水在二氧化锰做催化剂作用下容易分解生成进行设计实验,完成本题解答;
(4)双氧水不稳定,分解生成水和氧气,所以在过氧化钠与水反应的方程式中没有写出双氧水.
(2)钠元素形成了稳定的化合物,则另一种不稳定的、具有漂白性的物质只能为具有强氧化性的双氧水;
(3)根据双氧水在二氧化锰做催化剂作用下容易分解生成进行设计实验,完成本题解答;
(4)双氧水不稳定,分解生成水和氧气,所以在过氧化钠与水反应的方程式中没有写出双氧水.
解答:解:(1)过氧化钠与水的反应方程式中只有氢氧化钠和氧气生成,所以褪色原因的猜想只能由三种情况:氧气具有漂白性、氢氧化钠具有漂白性、氧气和氢氧化钠共同作用具有漂白性;实验1中,将酚酞加入氢氧化钠溶液中,目的是证明褪色原因是否原因氢氧化钠引起的,所以对应的猜想为B;实验3通入氧气,目的是证明氧气能够使溶液褪色;为了增强说服力,避免干扰,实验1、2中氢氧化钠溶液必须是用氢氧化钠固体配制的,
故答案为:氧气和氢氧化钠共同作用具有漂白性;B;A;氢氧化钠固体;
(2)过氧化钠与水反应过程中,钠元素形成了稳定的化合物,其它元素组合形成的不很稳定、具有漂白性的物质X,X只能为具有强氧化性的H2O2,
故答案为:H2O2;
(3)双氧水在催化剂二氧化锰作用下能够分解放出氧气,图中装置目的是探究双氧水的不稳定性,所以在①处装入的物质为过氧化钠与水反应后的混合液,②处装入的物质为催化剂二氧化锰,
故答案为:B; C;
(4)装置中气体③为双氧水分解生成的氧气;由于过氧化钠与水的反应中,生成的双氧水不稳定,已经分解生成氧气,所以没有写出双氧水分子,
故答案为:O2;H2O2不稳定,已分解.
故答案为:氧气和氢氧化钠共同作用具有漂白性;B;A;氢氧化钠固体;
(2)过氧化钠与水反应过程中,钠元素形成了稳定的化合物,其它元素组合形成的不很稳定、具有漂白性的物质X,X只能为具有强氧化性的H2O2,
故答案为:H2O2;
(3)双氧水在催化剂二氧化锰作用下能够分解放出氧气,图中装置目的是探究双氧水的不稳定性,所以在①处装入的物质为过氧化钠与水反应后的混合液,②处装入的物质为催化剂二氧化锰,
故答案为:B; C;
(4)装置中气体③为双氧水分解生成的氧气;由于过氧化钠与水的反应中,生成的双氧水不稳定,已经分解生成氧气,所以没有写出双氧水分子,
故答案为:O2;H2O2不稳定,已分解.
点评:本题考查了过氧化钠与水的反应原理,题目难度不大,试题注重考查性质实验方案的设计,注意掌握过氧化钠的性质,正确书写过氧化钠与水反应的化学方程式,明确双氧水具有强氧化性、漂白性.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
| |||||||||||||||||||||||
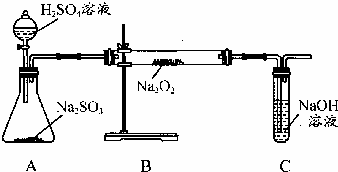 某化学学习小组的同学为探究过氧化钠与二氧化硫的反应,用如图所示的装置进行实验.通入足量的气体后将带火星的木条插入试管C中木条复燃.请回答下列问题
某化学学习小组的同学为探究过氧化钠与二氧化硫的反应,用如图所示的装置进行实验.通入足量的气体后将带火星的木条插入试管C中木条复燃.请回答下列问题