题目内容
15.实验室需用480mL0.1mol/L的硫酸铜溶液,以下操作正确的是( )| A. | 选用480 mL容量瓶,称取12.0g硫酸铜,配成480mL溶液 | |
| B. | 选用250 mL容量瓶,称取12.5g胆矾,配成500mL溶液 | |
| C. | 选用500 mL容量瓶,称取12.5g胆矾,加入500mL水 | |
| D. | 选用500 mL容量瓶,称取12.5g胆矾,配成500mL溶液 |
分析 需要480mL溶液,实际只能配置500mL,根据n=c×V计算溶质的物质的量,配制硫酸铜溶液可以用硫酸铜,也可以用胆矾,根据m=n×M计算各自质量,配制溶液时注意水的体积不等于溶液的体积,据此解答.
解答 解:A.实验室没有480mL容量瓶,应选择500mL容量瓶,配制500mL溶液,故A错误;
B.需用480mL0.1mol/L的硫酸铜溶液,实验室没有480mL容量瓶,应选择500mL容量瓶,配制500mL溶液,故B错误;
C.12.5g胆矾物质的量为:0.05mol,加入500mL水,溶液的体积大于500mL,溶液浓度小于0.1mol/L,故C错误;
D.12.5g胆矾物质的量为:0.05mol,配成500mL溶液,溶液浓度等于0.1mol/L,故D正确;
故选:D.
点评 本题考查一定物质的量浓度的溶液的配制,难度不大,注意配制一定物质的量浓度的溶液的配制方法,注意容量瓶规格的选择,注意溶液体积与溶剂体积的区别.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.A、B、C、D为原子序数依次增大的四种短周期元素,A、D同主族,B、C同周期.它们中的两种元素可形成多种原子个数比为1:1的化合物,甲、乙、丙为其中的三种,它们的元素组成如下表:
通常情况下,甲为气体,密度比空气小;乙为液体;丙为固体且为离子化合物.请填写下列空白:
(1)乙的电子式为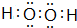 ,丙中阴离子与阳离子的个数比为1:2
,丙中阴离子与阳离子的个数比为1:2
(2)已知甲是同系列中最简单的化合物,且在标准状况下,5.6L的甲完全燃烧放出的热量为325kJ,试写出甲的燃烧热的热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol
(3)研究表明,乙是一种二元弱酸,请写出乙在水中的电离方程式H2O2?H++HO2-,HO2-?H++O2-
(4)A、B、C、D所对应元素的原子半径大小顺序为Na>C>O>H (用元素符号表示).
| 化合价 | 甲 | 乙 | 丙 |
| 元素种类 | A、B | A、C | C、D |
(1)乙的电子式为
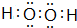 ,丙中阴离子与阳离子的个数比为1:2
,丙中阴离子与阳离子的个数比为1:2(2)已知甲是同系列中最简单的化合物,且在标准状况下,5.6L的甲完全燃烧放出的热量为325kJ,试写出甲的燃烧热的热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol
(3)研究表明,乙是一种二元弱酸,请写出乙在水中的电离方程式H2O2?H++HO2-,HO2-?H++O2-
(4)A、B、C、D所对应元素的原子半径大小顺序为Na>C>O>H (用元素符号表示).
12.下列说法正确的是( )
| A. | 摩尔是一个物理量 | B. | 物质的量就是物质的粒子数目 | ||
| C. | 硫酸的摩尔质量是98 g | D. | 18 g水中含有1 molH2O |
10.下列实验中均要用到的仪器是( )
①配制一定物质的量浓度的溶液
②溶解
③过滤
④蒸发
⑤pH试纸的使用.
①配制一定物质的量浓度的溶液
②溶解
③过滤
④蒸发
⑤pH试纸的使用.
| A. | 容量瓶 | B. | 漏斗 | C. | 胶头滴管 | D. | 玻璃棒 |
20.下列实验操作正确的是( )
| A. |  闻气体气味 | B. |  加热水 | C. | 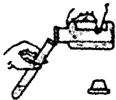 倾倒液体 | D. | 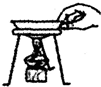 移走蒸发皿 |
7.下列实验操作或结论正确的是( )
| A. | 鉴别乙烷与乙烯或除去乙烷中的少量乙烯杂质都可用高锰酸钾酸性溶液 | |
| B. | 某同学需用480 mL 2.0 moI•L-1氢氧化钠溶液进行实验,则配制该溶液时他称取氢氧化钠固体质量一定是38.4 g | |
| C. | 向含Fe3+的溶液中加入KSCN溶液时一定有红褐色沉淀产生 | |
| D. | 硝酸钾和稀硫酸的混合溶液中加入铜粉后,溶液会慢慢变蓝 |
5.在密闭容器中,加热2amol的NaHCO3和amol的Na2O2的固体混合物,充分反应后,容器中的固体剩余物是( )
| A. | Na2CO3和NaOH | B. | Na2CO3 | ||
| C. | NaOH和Na2O2 | D. | NaOH、Na2O2和Na2CO3 |


 钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛应用.
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛应用.