题目内容
元素周期律是指元素的性质随 的递增,而呈 性变化的规律,这里元素的性质主要是指 和 ;元素性质周期性变化是 呈周期性变化的必然结果.
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:元素周期律为元素性质随原子结构的周期性变化而发生周期性变化的必然结构,以此来解答.
解答:
解:元素周期律是指元素的性质随原子序数的递增,而呈周期性变化的规律,这里元素的性质主要是指金属性和非金属性;元素性质周期性变化是原子结构呈周期性变化的必然结果,
故答案为:原子序数;周期性;金属性;非金属性;原子结构.
故答案为:原子序数;周期性;金属性;非金属性;原子结构.
点评:本题考查元素周期律,把握元素周期律的实质及元素周期律的内容为解答的关键,注意原子结构决定元素的性质,题目难度不大.

练习册系列答案
相关题目
下列措施中,能减慢化学反应速率的是( )
| A、食物储存在冰箱里 |
| B、将块状固体药品研细后再反应 |
| C、用MnO2作H2O2分解反应的催化剂 |
| D、用30%H2SO4溶液代替5%H2SO4溶液与锌粒反应 |
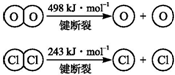
 氧化铁在工业上具有广泛的应用.
氧化铁在工业上具有广泛的应用.
