题目内容
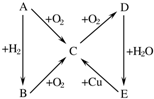
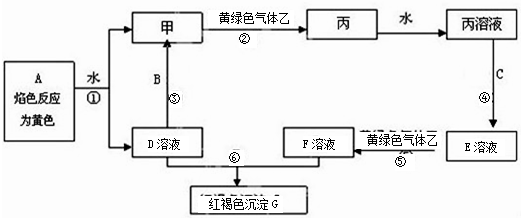
如图转化关系中所有物质均为中学常见物质,且反应中的部分产物已略去.A、F为银白色金属,D、X均为无色无味的气体单质,Z为黄绿色气体单质,其余物质均为化合物.Y为红棕色粉末,常用作红色油漆和涂料.

请按要求回答下列问题:
(1)Z的化学式为______.
(2)在实验室中,欲检验H溶液中的金属阳离子,先向溶液中滴加几滴______溶液,再加入几滴氯水,观察到溶液变为______色,证明原溶液中的金属阳离子为______.
(3)B与NaOH溶液反应的离子方程式为______.
(4)A与Y反应生成F的化学方程式为______.
(5)等质量的A分别与足量的G溶液、NaOH溶液充分反应后,相同条件下产生气体D的体积比为______.

请按要求回答下列问题:
(1)Z的化学式为______.
(2)在实验室中,欲检验H溶液中的金属阳离子,先向溶液中滴加几滴______溶液,再加入几滴氯水,观察到溶液变为______色,证明原溶液中的金属阳离子为______.
(3)B与NaOH溶液反应的离子方程式为______.
(4)A与Y反应生成F的化学方程式为______.
(5)等质量的A分别与足量的G溶液、NaOH溶液充分反应后,相同条件下产生气体D的体积比为______.
银白色金属A能与NaOH溶液反应得到E与无色无味的气体单质D,可推知A为Al、E为NaAlO2、D为H2,Z为黄绿色气体单质,则Z为Cl2,Z与D反应得到G为HCl,Y为红棕色粉末,常用作红色油漆和涂料,则Y为Fe2O3,A与Y在高温下反应得到金属单质F为Fe,Fe与G、水反应得到化合物H为FeCl2,Al与G溶液(盐酸)反应得到化合物C为
AlCl3,Al与无色无味气体单质X反应得到B,B溶于盐酸得到C,可推知X为O2、B为Al2O3,
(1)由上述分析可知,Z的化学式为Cl2,故答案为:Cl2;
(2)欲检验FeCl2溶液中的金属阳离子,先向溶液中滴加几滴KSCN溶液,再加入几滴氯水,观察到溶液变为红色,证明原溶液中的金属阳离子为Fe2+,故答案为:KSCN;红;Fe2+;
(3)B为Al2O3,与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)A与Y反应生成F的化学方程式为:2Al+Fe2O3
Al2O3+2Fe,故答案为:2Al+Fe2O3
Al2O3+2Fe;
(5)等质量的Al分别与足量的HCl溶液、NaOH溶液充分反应后,都生成氢气,反应中Al元素化合价都由0价升高为+3价,由于Al完全反应,故转移电子数目相等,故生成氢气的体积相等,即生成氢气体积之比为1:1,故答案为:1:1.
AlCl3,Al与无色无味气体单质X反应得到B,B溶于盐酸得到C,可推知X为O2、B为Al2O3,
(1)由上述分析可知,Z的化学式为Cl2,故答案为:Cl2;
(2)欲检验FeCl2溶液中的金属阳离子,先向溶液中滴加几滴KSCN溶液,再加入几滴氯水,观察到溶液变为红色,证明原溶液中的金属阳离子为Fe2+,故答案为:KSCN;红;Fe2+;
(3)B为Al2O3,与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)A与Y反应生成F的化学方程式为:2Al+Fe2O3
| ||
| ||
(5)等质量的Al分别与足量的HCl溶液、NaOH溶液充分反应后,都生成氢气,反应中Al元素化合价都由0价升高为+3价,由于Al完全反应,故转移电子数目相等,故生成氢气的体积相等,即生成氢气体积之比为1:1,故答案为:1:1.

练习册系列答案
相关题目