题目内容
6.FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应时首先生成H2S2,H2S2类似于H2O2,易分解:H2S2═H2S+S↓.实验室制取H2S时,某学生误将FeS2当作了FeS反应完后,不可能生成的物质为( )| A. | H2S | B. | S | C. | Fe2+ | D. | Fe3+ |
分析 根据发生的FeS2+2HCl=H2S2+FeCl2、H2S2=H2S+S的反应进行判断.
解答 解:FeS2颗粒与盐酸发生:FeS2+2HCl=H2S2+FeCl2,H2S2类似于H2O2,易分解,发生H2S2=H2S+S,反应产物可能有H2S、S、Fe2+,
Fe3+具有较强的氧化性能氧化H2S,不可能生成的是Fe3+,
故选D.
点评 本题考查含硫物质的性质、氧化还原反应,题目难度中等,本题注意题中信息,学习中注意信息迁移能力的培养.

练习册系列答案
相关题目
1.目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍能形成多种不同的化合物.图1是镍的一种配合物的结构,图2是一种镍的氧合物的晶胞.判断下列说法正确的是( )
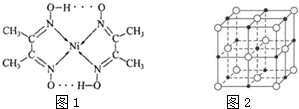

| A. | 图2可能表示的是氧化镍(NiO)的晶胞 | |
| B. | 图1中C、N、O的第一电离能C>N>O | |
| C. | 图2中离镍原子最近的镍原子数共为8个 | |
| D. | 图1分子中存在的化学键有共价键、配位键、氢键 |
18.有机物分子中不同结构之间能相互影响导致物质化学性质不同,下列各项事实能够说明侧链对苯环有影响的是
①苯酚与溴水常温下可以反应,而苯与溴水不能反应
②甲苯能使酸性高锰酸钾溶液褪色,而乙烷不能使酸性高锰酸钾溶液褪色
③苯酚与氢氧化钠溶液可以反应,而乙醇不能与氢氧化钠溶液发生反应
④甲苯与浓硝酸(浓硫酸/△)作用可得到2,4,6-三硝基甲苯,而苯与浓硝酸(浓硫酸/△)作用得到硝基苯( )
①苯酚与溴水常温下可以反应,而苯与溴水不能反应
②甲苯能使酸性高锰酸钾溶液褪色,而乙烷不能使酸性高锰酸钾溶液褪色
③苯酚与氢氧化钠溶液可以反应,而乙醇不能与氢氧化钠溶液发生反应
④甲苯与浓硝酸(浓硫酸/△)作用可得到2,4,6-三硝基甲苯,而苯与浓硝酸(浓硫酸/△)作用得到硝基苯( )
| A. | 只有②③ | B. | 只有①④ | C. | 只有①③④ | D. | ①②③④ |
16.下列叙述正确的是( )
| A. | 金属锂的化学性质类似于金属钠,在加热的条件下锂与氧气反应生成过氧化锂 | |
| B. | K2O2中含有的阴阳离子个数比为1:1 | |
| C. | 在HCl分子中中各原子最外层均达到8电子稳定结构 | |
| D. | 同周期主族元素(除0族元素外)从左到右,原子半径逐渐减小 |

