题目内容
17.元素周期表共有7个横行,每一横行称为一个周期,故元素周期表共有7个周期,我们把1、2、3周期称为短周期,456 周期称为长周期,第7周期称为不完全周期,因为一直有未知元素在发现.周期序数与电子层数的关系周期数=电子层数.分析 把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行称为周期,把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行称为族,元素周期表共有18个纵行,16个族,七个周期,周期表中1、2、3为短周期,4、5、6为长周期,第7周期为不完全周期.
解答 解:把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行称为周期,把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行称为族,元素周期表共有18个纵行,16个族,7个周期,周期表中1、2、3为短周期,4、5、6为长周期,第7周期为不完全周期,元素的周期数等于原子的电子层数,
故答案为:7;周期;7;短周期;456;7;周期数=电子层数.
点评 本题考查了元素周期表的结构,题目难度不大,侧重于基础知识的考查,注意把握周期和族的编排依据.

练习册系列答案
相关题目
19.下列条件下,两种气体的分子数一定不相等的是( )
| A. | 相同质量、不同密度的N2O和CO2 | |
| B. | 相同体积、相同密度的CO和C2H4 | |
| C. | 相同温度、相同压强、相同体积的O2和N2 | |
| D. | 相同压强、相同体积、相同质量的NO2和N2O5 |
12.判断下列元素既不属于主族元素又不属于短周期元素的是( )
| A. | 钾 | B. | 氧 | C. | 镧 | D. | 氯 |
9.下列叙述正确的是( )
| A. | 元素性质呈周期性变化的根本原因是元素原子半径大小呈周期性变化 | |
| B. | 碘单质溶于酒精时,共价键被破坏 | |
| C. | 任何原子或离子的组成中都含有质子 | |
| D. | 同位素的不同核素物理、化学性质完全相同 |
 的单体是:
的单体是: .
. 的单体是:CH3CH=CH2、CH2=CH2.
的单体是:CH3CH=CH2、CH2=CH2.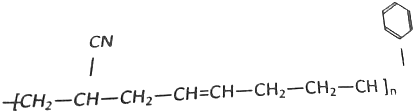 合成此高分子化合物用了三种单体,这三种单体的结构简式分别是CH2=CH-CN、CH2=CH-CH=CH2、
合成此高分子化合物用了三种单体,这三种单体的结构简式分别是CH2=CH-CN、CH2=CH-CH=CH2、 .
.
