题目内容
16.下列叙述正确的是( )| A. | 金属锂的化学性质类似于金属钠,在加热的条件下锂与氧气反应生成过氧化锂 | |
| B. | K2O2中含有的阴阳离子个数比为1:1 | |
| C. | 在HCl分子中中各原子最外层均达到8电子稳定结构 | |
| D. | 同周期主族元素(除0族元素外)从左到右,原子半径逐渐减小 |
分析 A.Li与氧气只生成氧化锂;
B.K2O2中含有一个O22-;
C.H原子只能达到2电子稳定结构;
D.电子层数相同的原子,原子序数越大,半径越小.
解答 解:A.Li的金属性比钠弱,Li与氧气反应只生成氧化锂,不能生成过氧化锂,故A错误;
B.K2O2中含有一个O22-,则阴阳离子个数比为1:2,故B错误;
C.H原子只能达到2电子稳定结构,在HCl分子中只有Cl原子最外层达到8电子稳定结构,故C错误;
D.电子层数相同的原子,原子序数越大,半径越小,则同周期主族元素从左到右,原子半径逐渐减小,故D正确.
故选D.
点评 本题考查了同主族、同周期元素性质的递变规律,题目难度不大,注意把握元素周期律的有关内容.

练习册系列答案
相关题目
6.FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应时首先生成H2S2,H2S2类似于H2O2,易分解:H2S2═H2S+S↓.实验室制取H2S时,某学生误将FeS2当作了FeS反应完后,不可能生成的物质为( )
| A. | H2S | B. | S | C. | Fe2+ | D. | Fe3+ |
4.有关下列实验的说法,错误的是( )
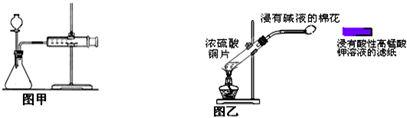

| A. | 硝酸钾制备实验中,将NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤时,可以分离出硝酸钾 | |
| B. | 重结晶过程中产生的母液虽然含有杂质,但仍应将母液收集起来,进行适当处理,以提高产率 | |
| C. | 甲装置可用于某些化学反应速率的测定.该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处 | |
| D. | 乙装置可用来制取和检验二氧化硫气体漂白性,待滤纸颜色褪去后立即用浸有碱液的棉花堵住试管口 |
1.已知某元素的+2价离子的电子排布式为1s22s22p63s23p6,则该元素在周期表中的位置正确的是( )
| A. | 第三周期ⅣA族,p区 | B. | 第四周期ⅡA族,s区 | ||
| C. | 第四周期Ⅷ族,d区 | D. | 第四周期ⅡB族,s区 |
5.下列措施不合理的是( )
| A. | 用SO2漂白纸浆和草帽 | |
| B. | 用硫酸清洗锅炉中的水垢 | |
| C. | 实验室盛装NaOH玻璃试剂瓶用橡皮塞 | |
| D. | 漂白粉应该要密封,干燥保存 |
6.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 2molNa被完全氧化生成Na2O2,失去个2nA电子 | |
| B. | 1 mol•L-1 的K2SO4溶液中有2nA个K+ | |
| C. | 常温常压下,22.4 L乙烯中C-H键的数目为4nA | |
| D. | 常温常压下,16gCH4中含有的电子数为10nA |
 2009年诺贝尔化学奖奖励的是对生命一个核心过程的研究--核糖体将DNA信息“翻译”成生命,三位科学家利用X射线结晶学技术标出了构成核糖体的无数个原子每个所在的位置.
2009年诺贝尔化学奖奖励的是对生命一个核心过程的研究--核糖体将DNA信息“翻译”成生命,三位科学家利用X射线结晶学技术标出了构成核糖体的无数个原子每个所在的位置. .
.