题目内容
【题目】在化学研究中,往往可以通过观察现象认识物质变化的情况.请分析以下一组有现象变化的化学反应.
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
| 饱和Na2SlO3溶液(含2滴酚酞) | 先滴加1.0mL0.5molL﹣1NaOH溶液:再滴加1.5mL1.0molL﹣1H2SO4溶液 | Ⅰ.红色溶液中出现胶状沉淀 |
0.1molL﹣1AlCl3溶液 | Ⅱ.加碱时 ;加酸时产生白色沉淀,又逐渐溶解直至消失 | ||
0.1molL﹣1Fe(NO3)2溶液 | Ⅲ.加碱时 ;加酸后溶液变为黄色 | ||
新制饱和氯水 | Ⅳ.加碱时溶液变为无色;加酸后无色溶液变为浅黄绿色 | ||
(1)用离子方程式解释现象I中出现胶状沉淀的原因: .
(2)II中加碱时出现的现象是 , 此现象说明溶液中发生反应的离子方程式是 .
(3)III中加碱时出现的现象是 .
(4)用离子方程式解释IV中加碱时出现的现象 .
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验.
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
| 0.1 molL﹣1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 molL﹣1 H2SO4溶液; | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
①探究加酸时Fe(NO3)2溶液中是否发生了反应:
向1.0mL 0.1molL﹣1Fe(NO3)2溶液中 , 溶液立即变红,说明溶液中含Fe3+ , 证明加酸时溶液中发生了反应.
②推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1molL﹣1 Fe(NO3)2溶液中的Fe2+被NO3﹣氧化;
b.(用离子方程式表示).
【答案】
(1)2H++SiO32﹣═H2SiO3↓
(2)出现白色沉淀,又逐渐溶解直至消失;Al3++3OH﹣═Al(OH)3↓、Al(OH)3+OH﹣═AlO2﹣+2H2O
(3)生成白色沉淀迅速变成灰绿色,最后变成红褐色
(4)Cl2+2OH﹣═ClO﹣+Cl﹣+H2O
(5)滴加KSCN溶液,没有明显现象,再向其中滴加1.5mL1.0mol?L﹣1H2SO4溶液;4Fe2++O2+4H+═4Fe3++2H2O
【解析】解:(1)用离子方程式解释现象I中出现胶状沉淀的原因是硅酸钠和硫酸反应生成硅酸沉淀,反应的离子方程式为:2H++SiO32﹣═H2SiO3↓,
所以答案是:2H++SiO32﹣═H2SiO3↓;(2)1mL 0.1molL﹣1AlCl3溶液中先滴加1.0mL0.5molL﹣1NaOH溶液:再滴加1.5mL1.0molL﹣1H2SO4溶液,计算物质的量可知氢氧化钠物质的量为0.0005mol,铝离子物质的量为0.0001mol,Al3++3OH﹣=Al(OH)3↓,碱过量生成氢氧化铝会随氢氧化钠滴入溶解得到偏铝酸钠溶液,Al(OH)3+OH﹣=AlO2﹣+2H2O,生成AlO2﹣物质的量=0.0001mol,剩余0.0001molNaOH,沉淀消失,再滴加1.5mL1.0molL﹣1H2SO4溶液,溶液中氢离子物质的量=0.0015L×1.0mol/L×2=0.003mol,滴入硫酸溶液先中和氢氧根离子,偏铝酸根离子结合氢离子生成氢氧化铝沉淀,发生反应H++OH﹣=H2O,AlO2﹣+H++H2O=Al(OH)3↓,硫酸过量继续滴入生成的氢氧化铝会全部溶解,
所以答案是:出现白色沉淀,又逐渐溶解直至消失;Al3++3OH﹣═Al(OH)3↓、Al(OH)3+OH﹣═AlO2﹣+2H2O;(3)0.1molL﹣1Fe(NO3)2溶液中滴入先滴加1.0mL0.5molL﹣1NaOH溶液:再滴加1.5mL1.0molL﹣1H2SO4溶液,生成氢氧化亚铁不是沉淀迅速变化为灰绿色最后变化为红褐色沉淀,
所以答案是:生成白色沉淀迅速变成灰绿色,最后变成红褐色;(4)新制饱和氯水中加碱时溶液变为无色是氯气和碱反应生成氯化钠、次氯酸钠和水,用离子方程式解释IV中加碱时出现的现象为:Cl2+2OH﹣═ClO﹣+Cl﹣+H2O,
所以答案是:Cl2+2OH﹣═ClO﹣+Cl﹣+H2O;(5)①向1.0mL 0.1molL﹣1Fe(NO3)2溶液中滴加KSCN溶液,没有明显现象,再向其中滴加1.5 mL 1.0 molL﹣1 H2SO4溶液,溶液立即变红,说明溶液中含Fe3+ , 证明加酸时溶液中发生了反应,
所以答案是:滴加KSCN溶液,没有明显现象,再向其中滴加1.5 mL 1.0 molL﹣1 H2SO4溶液;
②空气中的氧气会也会亚铁离子生成铁离子,反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,
所以答案是:4Fe2++O2+4H+═4Fe3++2H2O;
【考点精析】利用胶体的重要性质对题目进行判断即可得到答案,需要熟知胶体的性质:①丁达尔现象(可用来鉴别胶体和溶液) ②布朗运动 ③电泳现象 ④胶体聚沉(加入电解质、加入带异种电荷的胶体、加热,均可使胶体聚沉).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某实验小组同学模拟工业制碘的方法,探究ClO3﹣和I﹣的反应规律.实验操作及现象如表:
实验及试剂 | 编号 | 无色NaClO3 | 试管中 | 淀粉KI |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如图实验: 
经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3﹣和I﹣发生反应的离子方程式: .
(2)查阅资料:一定条件下,I﹣和I2都可以被氧化成IO3﹣ .
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2 .
进行实验:
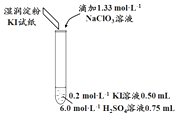
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3﹣ . 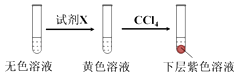
其中试剂X可以是(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2 , 便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33molL﹣1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是 , 进一步佐证实验4中生成了Cl2 . 获得结论:NaClO3溶液用量增加导致溶液褪色的原因是(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
编号 | 6.0 molL﹣1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 .
②用离子方程式解释实验6的现象: .