题目内容
常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、NO2-、I-、SO42-中的4种,且各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示:

下列有关说法正确的是( )

下列有关说法正确的是( )
| A、该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子 |
| B、实验消耗Cu14.4g,则生成气体丁的体积为3.36L |
| C、沉淀乙一定有BaCO3,可能有BaSO4 |
| D、为确定原溶液中是否有K+,可通过焰色反应直接观察焰色是否为紫色来确定 |
考点:常见阴离子的检验,常见阳离子的检验
专题:物质检验鉴别题
分析:由溶液pH=1可知溶液为酸性溶液,溶液中存在大量氢离子,可以排除CO32-、NO2-;
溶液A中加过量(NH4)2CO3,产生白色沉淀,白色沉淀只能为氢氧化铝,可以排除Fe2+、Fe3+,溶液含有一定有Al3+;
溶液乙加铜和浓硫酸能产生气体丙,丙在空气中变成红棕色,则丙为NO,原溶液中有NO3-,强酸性溶液中含有NO3-,则一定不存在具有还原性的离子:Fe2+、I-,最后根据电荷守恒得原溶液中含有H+、NO3-、Al3+、SO42- Cl-五种离子.
溶液A中加过量(NH4)2CO3,产生白色沉淀,白色沉淀只能为氢氧化铝,可以排除Fe2+、Fe3+,溶液含有一定有Al3+;
溶液乙加铜和浓硫酸能产生气体丙,丙在空气中变成红棕色,则丙为NO,原溶液中有NO3-,强酸性溶液中含有NO3-,则一定不存在具有还原性的离子:Fe2+、I-,最后根据电荷守恒得原溶液中含有H+、NO3-、Al3+、SO42- Cl-五种离子.
解答:
解:由溶液pH=1可知溶液为酸性溶液,氢离子浓度为0.1mol/L,溶液中一定不存在与氢离子反应的离子:CO32-、NO2-;
溶液A中加过量(NH4)2CO3,产生白色沉淀,可以排除Fe2+、Fe3+,原溶液中一定有Al3+;
溶液乙加铜和浓硫酸能产生NO,原溶液中有NO3-,强酸性溶液中有NO3-,则一定没有Fe2+、I-;
A.根据以上分析可知,溶液中存在0.1mol/L的氢离子、0.1mol/L的铝离子,溶液中阳离子带有的电荷为:0.4mol/L;而溶液中除了存在0.1mol/L的硝酸根离子外,还应该含有SO42-离子和Cl-,所以该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子,故A正确;
B.根据反应方程式3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O可知,消耗14.4g铜,生成一氧化氮气体的物质的量为:
×
=0.15mol,由于没有告诉是标准状况下,0.15mol一氧化氮的体积不一定为3.35L,故B错误;
C.根据分析可知,溶液中含有硫酸根离子,所以沉淀乙中一定为碳酸钡和硫酸钡沉淀的化合物,故C错误;
D.确定原溶液中是否有K+,可以通过焰色反应检验,观察时需要透过蓝色的钴玻璃,以便滤去钠离子的黄色,不能直接观察,故D错误;
故选A.
溶液A中加过量(NH4)2CO3,产生白色沉淀,可以排除Fe2+、Fe3+,原溶液中一定有Al3+;
溶液乙加铜和浓硫酸能产生NO,原溶液中有NO3-,强酸性溶液中有NO3-,则一定没有Fe2+、I-;
A.根据以上分析可知,溶液中存在0.1mol/L的氢离子、0.1mol/L的铝离子,溶液中阳离子带有的电荷为:0.4mol/L;而溶液中除了存在0.1mol/L的硝酸根离子外,还应该含有SO42-离子和Cl-,所以该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子,故A正确;
B.根据反应方程式3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O可知,消耗14.4g铜,生成一氧化氮气体的物质的量为:
| 14.4g |
| 64g/mol |
| 2 |
| 3 |
C.根据分析可知,溶液中含有硫酸根离子,所以沉淀乙中一定为碳酸钡和硫酸钡沉淀的化合物,故C错误;
D.确定原溶液中是否有K+,可以通过焰色反应检验,观察时需要透过蓝色的钴玻璃,以便滤去钠离子的黄色,不能直接观察,故D错误;
故选A.
点评:本题考查了常见阴阳离子的检验、离子共存的判断,题目难度中等,注意掌握常见离子的性质及检验方法,判断硫酸根离子、氯离子时需要通过电荷守恒进行判断,试题培养了学生的分析、理解能力.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案
相关题目
在40g密度为d g/cm3的硫酸铁溶液中,含有1.4g Fe3+离子,则此溶液中Fe3+的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列物质中,不含醛基的是( )
| A、C6H5CHO |
| B、CHOOC2H5 |
| C、(CH3)3CCH2OH |
| D、(CH3)2CH-CH=O |
既能发生加成反应、酯化反应,又能发生氧化反应的有机物是( )
| A、CH2=CH2 |
| B、CH2=CH-CH2OH |
| C、CH2=CH-COOCH3 |
| D、CH2=CH-COOH |
许多场所或产品的外包装常有一些标志,下列图标中属于物品回收标志的是( )
A、 |
B、 |
C、 |
D、 |
下列各组物质不能按“→”所示关系实现转化的是(“→”表示反应一步完成)( )
A、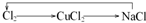 |
B、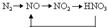 |
| C、S→SO2→H2SO4→MgSO4 |
| D、Al→Al2O3→Al(OH)3→NaAlO2 |
只用一种试剂就可鉴别乙酸、葡萄糖溶液、淀粉溶液,这种试剂是( )
| A、NaOH溶液 |
| B、稀H2SO4 |
| C、Cu(OH)2悬浊液 |
| D、Na2CO3溶液 |
葡萄糖是一种单糖的主要原因是( )
| A、在糖类结构中最简单 |
| B、不能再水解生成更简单的糖 |
| C、分子中含有一个醛基 |
| D、在所有糖类中碳原子数最少 |