题目内容
【题目】5.1镁铝混合物放入足量氢氧化钠溶液中充分反应后,生成气体在标准状况的体积为2.24L。
计算:(请写详细的计算步骤)
(1)混合物中含有镁的质量为多少克____________?
(2)若反应完成后,溶液体积为50mL,则溶液中含铝化合物的物质的量浓度为多少?______
【答案】3.3g 1.34mol/L
【解析】
由n=![]() 求出H2的物质的量,镁与氢氧化钠溶液不反应,根据2Al+2NaOH+2H2O=2NaAlO2+3H2↑计算出铝的物质的量,根据混合物的质量求出镁的质量;根据c=
求出H2的物质的量,镁与氢氧化钠溶液不反应,根据2Al+2NaOH+2H2O=2NaAlO2+3H2↑计算出铝的物质的量,根据混合物的质量求出镁的质量;根据c=![]() 求出NaAlO2 的物质的量浓度。
求出NaAlO2 的物质的量浓度。
标准状况下2.24L氢气的物质的量=![]() =0.1mol,
=0.1mol,
设铝的物质的量为x,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 3
x 0.1mol
所以,2:3=x:0.1mol,计算得出x=0.067mol,
混合物中含铝的质量为0.067mol![]() 27g/mol=1.8g,则
27g/mol=1.8g,则
(1)混合物中含有镁的质量为:5.1g-1.8g=3.3g,
(2)溶液体积为50mL,则溶液中NaAlO2的物质的量浓度为![]() =1.34mol/L,
=1.34mol/L,
因此,本题正确答案为:3.3g;1.34mol/L。

 阅读快车系列答案
阅读快车系列答案【题目】阅读、分析下列两个材料:
物 质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
根据上述材料回答下列问题(填写序号):
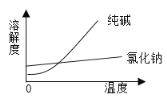
A、蒸馏法
B、萃取法
C、结晶法
D、分液法
(1)将纯碱从氯化钠和纯碱的混合物中分离出来的最佳方法是___________;
(2)将乙二醇和丙三醇相互分离的最佳方法是___________;
(3)分离汽油和水的最佳方法是___________;
(4)从碘水中提取单质碘的最佳方法是___________。
【题目】某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~29 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过查阅资料找到一种废钒催化剂的回收工艺流程路线如下:
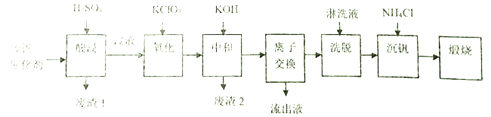
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则“废渣1”的主要成分是_____________。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式________________________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有__________(用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉定的化学方程式__________________。
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2D(g)△H=QkJ/mol。相关条件和数据见下表:
2D(g)△H=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验I | 实验II | 实验III |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 50 | 30 |
n(D)平衡/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是
A. 升高温度能加快反应速率的原理是降低了反应的活化能,使活化分子百分数提高
B. 实验III达平衡后,保持其他条件不变,再向容器中通入1molA和1molD,平衡不移动
C. 实验III达平衡后容器内的压强是实验1的9/10倍
D. K3>K2>K1