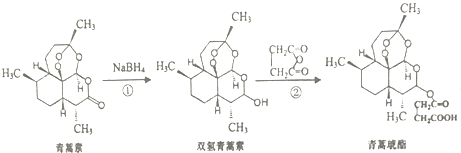
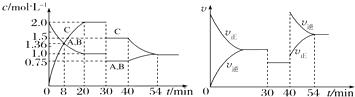
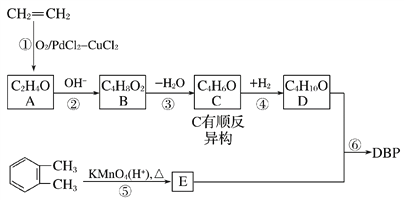
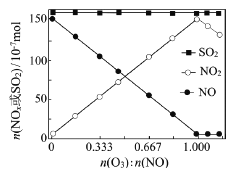
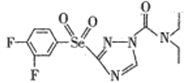
题目内容
【题目】250mL K2SO4和CuSO4的混合溶液中c(SO ![]() )=0.5molL﹣1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下).假定电解后溶液体积仍为250mL,下列说法不正确的是( )
)=0.5molL﹣1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下).假定电解后溶液体积仍为250mL,下列说法不正确的是( )
A.电解得到Cu的质量为3.2 g
B.上述电解过程中共转移电子0.2 mol
C.电解后的溶液中c(H+)=0.2 molL﹣1
D.原混合溶液中c(K+)=0.6 molL﹣1
【答案】C
【解析】解:石墨作电极电解此溶液,当通电一段时间后,两极均收集1.12L气体(标准状况),n(O2)=n(H2)= ![]() =0.05mol, 阳极发生 4OH﹣﹣4e﹣═O2↑+2H2O,
=0.05mol, 阳极发生 4OH﹣﹣4e﹣═O2↑+2H2O,
0.2mol 0.05mol
阴极发生Cu2++2e﹣═Cu、2H++2e﹣═H2↑,
0.05mol 0.1mol 0.1mol 0.1mol 0.1mol 0.05mol
A.电解得到的Cu的物质的量为0.05mol,质量为:64g/mol×0.05mol=3.2g,故A正确;
B.由上述分析可知,电解过程中转移电子总数为:0.05mol×4=0.2mol,故B正确;
C.电解后溶液中氢离子的物质的量浓度为:c(H+)= ![]() =0.4mol/L,故C错误;
=0.4mol/L,故C错误;
D.c(Cu2+)= ![]() =0.2mol/L,由电荷守恒可知,原混合溶液中c(K+)为:0.5mol/L×2﹣0.2mol/L×2=0.6mol/L,故D正确;
=0.2mol/L,由电荷守恒可知,原混合溶液中c(K+)为:0.5mol/L×2﹣0.2mol/L×2=0.6mol/L,故D正确;
故选C.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】甲醇既是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H﹣H | C﹣O | C≡O | H﹣O | C﹣H |
E/( kJmol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=______。已知ΔH2=﹣58 kJmol-1,则ΔH3=______。
(2)合成气中的氢气是发展中的新能源,它的利用包括制备、储存和应用三个环节。与汽油相比,氢气作为燃料的优点是__________________________________________________________(写出两点),缺点是______________________________________________________________________(写出两点)。