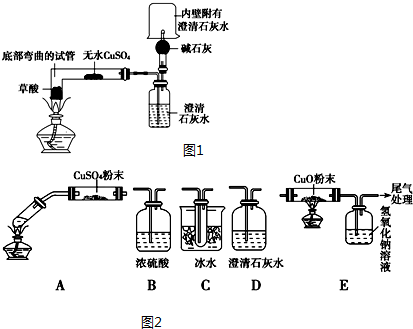
题目内容
8.(1)常温下,已知0.1mol•L-1一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8.①常温下,0.1mol•L-1HA溶液的pH=3
写出该酸(HA)与NaOH溶液反应的离子方程式HA+OH-=A-+H2O
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是c(A-)>c(Na+)>c(H+)>c(OH-)
③0.2mol•L-1 HA溶液与0.1mol•L-1 NaOH溶液等体积混合后所得溶液中:
c(H+)+c(HA)-c(OH-)=0.05mol•L-1.(溶液体积变化忽略不计)
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下 水的离子积常数Kw=10-13
①该温度下(t℃),将100mL 0.1mol•L-1的稀硫酸与100mL 0.4mol•L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=12
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是pHa+pHb=12.
分析 (1)①0.1mol•L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8,则c(OH-)=10-11mol/L,c(H+)=1.0×10-3mol/L,依据pH=-lgc(H+)计算该溶液的pH;根据计算判断HA为弱电解质,然后写出其与氢氧化钠溶液的反应的离子方程式;
②根据酸和碱的物质的量的相对大小确定溶液中的溶质,从而确定溶液的酸碱性,结合电离平衡、水解平衡、电荷守恒等确定溶液中各种离子浓度的相对大小;
③根据电荷守恒与物料守恒进行计算.
(2)pH=2的H2SO4溶液中氢离子的物质的量浓度为10-2mol/L,设该温度下水的离子积常数Kw=10-a,则pH=11的NaOH溶液中氢氧根离子浓度为:$\frac{1{0}^{-a}}{1{0}^{-11}}$mol/L,据此计算出a即可;
①根据硫酸中氢离子与氢氧化钠中氢氧根离子的物质的量判断过量,然后计算出反应后溶液中氢离子浓度,最后计算出其余的pH;
③混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量.
解答 解:(1)①0.1mol•L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8,根据水的离子积可得:c(OH-)=10-11mol/L、c(H+)=1.0×10-3mol/L,该溶液的pH=-lgc(H+)=3;说明HA在溶液中只能部分电离出氢离子,则HA为弱酸,该酸(HA)与NaOH溶液反应的离子方程式为:HA+OH-=A-+H2O,
故答案为:3;HA+OH-=A-+H2O;
②常温下pH=11的NaOH溶液中c(OH-)=10-3mol•L-1,HA是弱酸,酸的浓度远远大于氢离子浓度,溶液中的溶质是酸和盐,溶液呈酸性,所以溶液中氢离子浓度大于氢氧根离子浓度,酸根离子浓度大于钠离子浓度,溶液中4种离子物质的量浓度大小关系为:c(A-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(A-)>c(Na+)>c(H+)>c(OH-);
②0.2mol•L-1HA溶液与0.1mol•L-1NaOH溶液等体积混合后所得溶液中,由电荷守恒可得:c(Na+)+c(H+)=c(A-)+c(OH-),由物料守恒可得:2c(Na+)=c(A-)+c(HA),二者结合可得:c(H+)+c(HA)-c(OH-)=c(Na+)=$\frac{1}{2}$×0.1mol/L=0.05mol/L,
故答案为:0.05.
(2)设该温度下设该温度下水的离子积常数Kw=10-a,pH=2的H2SO4溶液中氢离子的浓度为10-2mol/L,
pH=11的NaOH溶液中氢离子浓度为10-11mol/L,则氢氧根离子浓度为:$\frac{1{0}^{-a}}{1{0}^{-11}}$mol/L=10(11-a)mol/L,
等体积的氢氧化钠、稀硫酸恰好反应,则氢离子与氢氧根离子浓度相等,即10-2mol/L=10(11-a)mol/L,解得a=13,
水的离子积常数Kw=10-13;故答案为:10-13;
①100mL 0.1mol•L-1的稀H2SO4溶液中氢离子的物质的量为:0.1mol/L×2×0.1L=0.02mol,
100mL 0.4mol•L-1的NaOH溶液中氢氧根离子的物质的量为:0.4mol/L×0.1mol=0.04mol,
两溶液混合后氢氧根离子过量,反应后氢氧根离子的浓度为:$\frac{0.04mol-0.02mol}{0.2L}$=0.1mol/L,
根据水的离子积常数Kw=10-13可得,溶液中氢离子浓度为:$\frac{1{0}^{-13}}{0.1}$mol/L=10-12mol/L,该溶液的pH=12,
故答案为:12;
②若1体积pH1=pHa的稀硫酸溶液中氢离子的物质的量浓度=10-pHa mol/L,10体积pH2=b的某强碱溶液中氢氧根离子的物质的量浓度=10 pHb-13 mol/L,混合后溶液呈中性,则氢离子的物质的量等于氢氧根离子的物质的量,所以1×10-pHa mol/L=10×10 pHb-13 mol/L,所以pHa+pHb=12,
故答案为:pHa+pHb=12.
点评 本题考查了酸碱混合后溶液定性判断及溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒、盐的水解原理正确判断溶液中各离子浓度大小.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案| A. | 100 mL | B. | 200 mL | C. | 300 mL | D. | 400 mL |

| A. | 异秦皮啶与秦皮素互为同系物 | |
| B. | 异秦皮啶分子式为C11H12O5 | |
| C. | 秦皮素一定条件下能发生加成反应、消除反应和取代反应 | |
| D. | 1mol秦皮素最多可与2molBr2、4molNaOH反应 |
| A. | 某温度时,1LpH=6的水溶液,含10-6mol OH-离子 | |
| B. | 含10.6gNa2CO3溶液中,所含阴离子总数等于0.1 mol | |
| C. | V L a mol/LFeCl3溶液中,若Fe3+离子数目为1mol,则Cl-离子数目大于3 mol | |
| D. | 电解精炼粗铜时,每转移1mol电子,阳极上溶解的Cu原子数必为0.5mol |
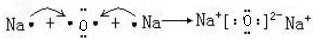


 →
→ .
.