题目内容
下图是200 mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(T)变化的曲线(已知草酸锰不稳定,但其中锰元素的化合价在300 ℃以下不变)。

试回答下列问题:
(1)写出B点固体产物的化学式:_________________________________________。
(2)从B点到C点过程中固体物质质量不变的原因是_____________________________________________________。
(3)通过计算确定D点产物的相对分子质量,并推断其合理的化学式:____________
(4)从D点到E点过程中固体物质质量增加的原因是___________________________

试回答下列问题:
(1)写出B点固体产物的化学式:_________________________________________。
(2)从B点到C点过程中固体物质质量不变的原因是_____________________________________________________。
(3)通过计算确定D点产物的相对分子质量,并推断其合理的化学式:____________
(4)从D点到E点过程中固体物质质量增加的原因是___________________________
(1)MnC2O4
(2)MnC2O4在100~205℃时较稳定
(3)产物为MnO,其相对分子质量为71
(4)MnO与空气中的O2发生化合反应,生成新的锰的氧化物
(2)MnC2O4在100~205℃时较稳定
(3)产物为MnO,其相对分子质量为71
(4)MnO与空气中的O2发生化合反应,生成新的锰的氧化物
结晶水合物受热,先失去结晶水(该过程也可能分步进行);继续受热将产生气态物质使固体质量减少,一般气体为氧气或气态氧化物,金属元素一定存在于固体中,可用差量法确定产物的组成;也有可能金属元素存在变价,在一定的温度下,与空气中的氧气反应生成其他价态的氧化物,使固体质量再次发生变化。(3)类比碳酸盐的分解并结合MnC2O4的分子组成及图像分析,D点产物由Mn和O两种元素组成。
n(Mn)= ≈0.001 12 mol
≈0.001 12 mol
n(O)=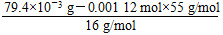 ≈0.001 12 mol
≈0.001 12 mol
n(Mn)∶n(O)=0.001 12 mol∶0.00112 mol=1∶1,故产物为MnO(满足化合价),其相对分子质量M=55+16=71。
n(Mn)=
 ≈0.001 12 mol
≈0.001 12 moln(O)=
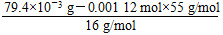 ≈0.001 12 mol
≈0.001 12 moln(Mn)∶n(O)=0.001 12 mol∶0.00112 mol=1∶1,故产物为MnO(满足化合价),其相对分子质量M=55+16=71。

练习册系列答案
相关题目
 共有的质子数为6.02×1023
共有的质子数为6.02×1023 来衡量过碳酸钠产品的优劣,13%以上者为优等品。
来衡量过碳酸钠产品的优劣,13%以上者为优等品。