题目内容
过碳酸钠俗称固体双氧水,是一种很好的消毒剂和供氧剂,化学式可表示为aNa2CO3·bH2O2,它具有Na2CO3和H2O2的双重性质。现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量的MnO2粉末,充分反应后生成672 mL气体(标准状况)。反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100 mL溶液A。现向三份体积为10 mL、浓度为c的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:
请回答下列问题:
(1)用化学方程式表示向过碳酸钠溶液中加入MnO2粉末时放出气体的原因:_______________________________________________________________。
(2)稀硫酸的物质的量浓度c=________ mol·L-1。
(3)通过计算可确定过碳酸钠的化学式为________。
(4)工业上常以所含活性氧的质量分数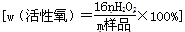 来衡量过碳酸钠产品的优劣,13%以上者为优等品。
来衡量过碳酸钠产品的优劣,13%以上者为优等品。
现将0.2 g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0 mL 1 mol·L-1硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1 mol·L-1 Na2S2O3溶液滴定到蓝色恰好消失时,共消耗33.00 mL,请通过计算判断该样品是否为优等品(要求写出计算过程)。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 5.0 | 10.0 | 15.0 |
| 生成气体的体积/mL(标准状况) | 44.8 | 89.6 | 112 |
请回答下列问题:
(1)用化学方程式表示向过碳酸钠溶液中加入MnO2粉末时放出气体的原因:_______________________________________________________________。
(2)稀硫酸的物质的量浓度c=________ mol·L-1。
(3)通过计算可确定过碳酸钠的化学式为________。
(4)工业上常以所含活性氧的质量分数
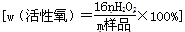 来衡量过碳酸钠产品的优劣,13%以上者为优等品。
来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2 g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0 mL 1 mol·L-1硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1 mol·L-1 Na2S2O3溶液滴定到蓝色恰好消失时,共消耗33.00 mL,请通过计算判断该样品是否为优等品(要求写出计算过程)。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
(1)2H2O2 2H2O+O2↑
2H2O+O2↑
(2)0.5
(3)2Na2CO3·3H2O2
(4)据题意可得:H2O2+2I-+2H+=2H2O+I2,2Na2S2O3+I2=Na2S4O6+2NaI。根据关系式H2O2~2Na2S2O3可知,n(H2O2)= =
= =1.65×10-3 mol
=1.65×10-3 mol
该过碳酸钠中活性氧的质量分数为
 ×16×100%=13.2%>13%
×16×100%=13.2%>13%
所以该过碳酸钠样品为优等品。
 2H2O+O2↑
2H2O+O2↑(2)0.5
(3)2Na2CO3·3H2O2
(4)据题意可得:H2O2+2I-+2H+=2H2O+I2,2Na2S2O3+I2=Na2S4O6+2NaI。根据关系式H2O2~2Na2S2O3可知,n(H2O2)=
 =
= =1.65×10-3 mol
=1.65×10-3 mol该过碳酸钠中活性氧的质量分数为
 ×16×100%=13.2%>13%
×16×100%=13.2%>13%所以该过碳酸钠样品为优等品。
(2)第Ⅲ次实验中加入溶液A的体积是第Ⅰ次实验中加入溶液A体积的3倍,但放出气体的体积不是3倍,说明第Ⅲ次实验中溶液A过量。取第Ⅲ次实验中的数据进行计算。
(3)n(H2O2)=2n(O2)= ×2=0.06 mol
×2=0.06 mol
由实验Ⅰ中数据可知,5 mL A溶液中:n(Na2CO3)=n(CO2)= =2×10-3 mol,所以100 mL A溶液中含有Na2CO3的物质的量为20×2×10-3 mol=0.04 mol。
=2×10-3 mol,所以100 mL A溶液中含有Na2CO3的物质的量为20×2×10-3 mol=0.04 mol。
n(Na2CO3)∶n(H2O2)=0.04∶0.06=2∶3,所以过碳酸钠的化学式为2Na2CO3·3H2O2。
(3)n(H2O2)=2n(O2)=
 ×2=0.06 mol
×2=0.06 mol由实验Ⅰ中数据可知,5 mL A溶液中:n(Na2CO3)=n(CO2)=
 =2×10-3 mol,所以100 mL A溶液中含有Na2CO3的物质的量为20×2×10-3 mol=0.04 mol。
=2×10-3 mol,所以100 mL A溶液中含有Na2CO3的物质的量为20×2×10-3 mol=0.04 mol。n(Na2CO3)∶n(H2O2)=0.04∶0.06=2∶3,所以过碳酸钠的化学式为2Na2CO3·3H2O2。

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案
相关题目