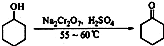题目内容
实验室以含有Ca2+、Mg2+、Cl-、SO42-、I-等离子的卤水为主要原料,制备无水CaCl2和I2.流程如下:(已知Cl2与I-可发生反应:Cl2+2I-=2Cl-+I2)
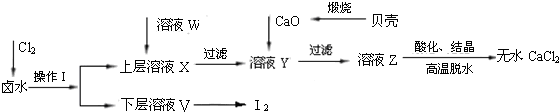
(1)操作Ⅰ使用的试剂是______,所用主要仪器的名称是______.
(2)加入溶液W的目的是______.用CaO调节溶液Y的pH,可以除去Mg2+.酸化溶液Z时使用的试剂是______.
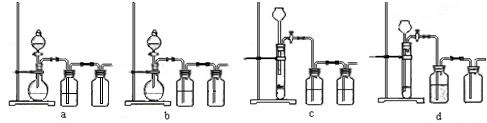
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是______.
(4)设计合理实验验证H2SO3酸性强于H2CO3,仪器自选.
供选的试剂:CO2、SO2、Na2CO3溶液、NaHCO3溶液、NaHSO3溶液、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸.
填写实验报告:

(1)操作Ⅰ使用的试剂是______,所用主要仪器的名称是______.
(2)加入溶液W的目的是______.用CaO调节溶液Y的pH,可以除去Mg2+.酸化溶液Z时使用的试剂是______.
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是______.

(4)设计合理实验验证H2SO3酸性强于H2CO3,仪器自选.
供选的试剂:CO2、SO2、Na2CO3溶液、NaHCO3溶液、NaHSO3溶液、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸.
填写实验报告:
| 实验步骤 | 现象 | 结论 |
______ | ______ | H2SO3酸性强于H2CO3 |
(1)氯气具有强氧化性,通入氯气后可以将溶液中的I-氧化成碘单质,因为单质碘极易溶于有机溶剂,所以可以采用萃取的方法,萃取的主要仪器是分液漏斗;由流程图可知单质碘在下层,因此该有机溶剂的密度要比水的大且不溶于水,所以该试剂是CCl4,
故答案为:四氯化碳;分液漏斗;
(2)由于SO42-会与Ca2+结合形成微溶性的硫酸钙而影响氯化钙的制备,因此必需除去;因为不能引入新的杂质,所以酸化溶液Z时,使用的试剂应该为盐酸,
故答案为:除去溶液中的SO42-;盐酸;
(3)实验室制取CO2的特点是固体和液体反应且不需要加热,由于盐酸易挥发,因此在收集之前需要出去挥发出HCl气体,因为CO2的密度大于空气中的,所以采用向上排空气发收集CO2气体.若采用长颈漏斗时,长颈漏斗的下端必须插入到溶液中,以防止CO2气体从长颈漏斗中挥发出来,因此选项b、d正确,
故答案为:b、d;
(4)H2SO3和H2CO3均属于二元酸,要检验酸性强弱,可以采用多种方法,例如利用水解原理(酸越弱相应的强碱盐就越易水解),也可以利用较强的酸制取较弱的酸来检验,由于SO2和CO2气体均可以使澄清石灰水变浑浊,所以CO2气体在通入澄清石灰水之前必需除去CO2气体中混有的SO2气体,且需验证SO2已经除尽,
用酸性KMnO4溶液除二氧化硫,用品红验证除尽,SO2依次通过NaHCO3或Na2CO3溶液,NaHCO3或Na2CO3溶液有气泡生成二氧化碳,二氧化碳使澄清石灰水变浑浊,说明H2SO3酸性强于H2CO3,
故答案为:
故答案为:四氯化碳;分液漏斗;
(2)由于SO42-会与Ca2+结合形成微溶性的硫酸钙而影响氯化钙的制备,因此必需除去;因为不能引入新的杂质,所以酸化溶液Z时,使用的试剂应该为盐酸,
故答案为:除去溶液中的SO42-;盐酸;
(3)实验室制取CO2的特点是固体和液体反应且不需要加热,由于盐酸易挥发,因此在收集之前需要出去挥发出HCl气体,因为CO2的密度大于空气中的,所以采用向上排空气发收集CO2气体.若采用长颈漏斗时,长颈漏斗的下端必须插入到溶液中,以防止CO2气体从长颈漏斗中挥发出来,因此选项b、d正确,
故答案为:b、d;
(4)H2SO3和H2CO3均属于二元酸,要检验酸性强弱,可以采用多种方法,例如利用水解原理(酸越弱相应的强碱盐就越易水解),也可以利用较强的酸制取较弱的酸来检验,由于SO2和CO2气体均可以使澄清石灰水变浑浊,所以CO2气体在通入澄清石灰水之前必需除去CO2气体中混有的SO2气体,且需验证SO2已经除尽,
用酸性KMnO4溶液除二氧化硫,用品红验证除尽,SO2依次通过NaHCO3或Na2CO3溶液,NaHCO3或Na2CO3溶液有气泡生成二氧化碳,二氧化碳使澄清石灰水变浑浊,说明H2SO3酸性强于H2CO3,
故答案为:
| 实验步骤 | 现象 | 结论 |
| 将SO2依次通过 NaHCO3或Na2CO3溶液、 酸性KMnO4溶液、 品红溶液、 澄清石灰水 | NaHCO3或Na2CO3溶液有气泡, 品红溶液不褪色, 澄清石灰水变浑浊 | H2SO3酸性强于H2CO3 |

练习册系列答案
相关题目