题目内容
(12分)
科学家一直致力研究常温、常压下“人工围氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3 h):
相应的热化学方程式如下:
N2(g)+3H2O(1)=2NH3(g)+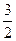 O2(g) ΔH=+765.2kJ·mol-1
O2(g) ΔH=+765.2kJ·mol-1
回答下列问题:
(1)请在答题卡的坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程
中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提
高其反应速率且增大NH3生成量的建议: 。
(3)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60 mol H2(g),.反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60 mol H2(g),.反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为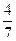 。计算
。计算
①该条件下N2的平衡转化率;
②该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。
N2(g)+3H2(g)的平衡常数。
科学家一直致力研究常温、常压下“人工围氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
N2(g)+3H2O(1)=2NH3(g)+
 O2(g) ΔH=+765.2kJ·mol-1
O2(g) ΔH=+765.2kJ·mol-1回答下列问题:
(1)请在答题卡的坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程
中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提
高其反应速率且增大NH3生成量的建议: 。
(3)工业合成氨的反应为N2(g)+3H2(g)
 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60 mol H2(g),.反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60 mol H2(g),.反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为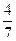 。计算
。计算①该条件下N2的平衡转化率;
②该条件下反应2NH3(g)
 N2(g)+3H2(g)的平衡常数。
N2(g)+3H2(g)的平衡常数。(1)画图略
(2)升高温度,增大反应物N2的浓度,不断移出生成物脱离反应体系。
(3)①该条件下N2的平衡转化率:66.7%
②该条件下反应2NH3(g) ="===" N2(g) +3H2(g)的平衡常数为0.005
(2)升高温度,增大反应物N2的浓度,不断移出生成物脱离反应体系。
(3)①该条件下N2的平衡转化率:66.7%
②该条件下反应2NH3(g) ="===" N2(g) +3H2(g)的平衡常数为0.005
(1)要点:
1.催化剂可降低反应的活化能,但对这各反应前后能量变化并不产生任何影响。
2.该反应为吸热反应,所以反应物的总能量要低于生成物的总能量。
(2)该反应正反应是吸热反应,升高温度,使化学平衡向正反应方向移动,从而增大NH3生成量,升高温度也能提高反应速率;增大反应N2浓度,加快反应速率,并使化学平衡向右移动;不断移出生成物脱离反应体系,使平衡向右移动,增大NH3生成量。
(3)由三行式法计算可知,起始时,c(N2)=0.3mol/l.平衡时,c(N2)=0.1mol/l;c(H2)="0.2mol/l;" c(NH3)="0.4mol/l" 。
①所以N2的平衡转化率=(0.3-0.1)/0.3*100%=66.7%
②反应2NH3(g) ="===" N2(g) +3H2(g)的平衡常数K=" c(N2)*" c(H2)^3/ c(NH3)^2=0.005
1.催化剂可降低反应的活化能,但对这各反应前后能量变化并不产生任何影响。
2.该反应为吸热反应,所以反应物的总能量要低于生成物的总能量。
(2)该反应正反应是吸热反应,升高温度,使化学平衡向正反应方向移动,从而增大NH3生成量,升高温度也能提高反应速率;增大反应N2浓度,加快反应速率,并使化学平衡向右移动;不断移出生成物脱离反应体系,使平衡向右移动,增大NH3生成量。
(3)由三行式法计算可知,起始时,c(N2)=0.3mol/l.平衡时,c(N2)=0.1mol/l;c(H2)="0.2mol/l;" c(NH3)="0.4mol/l" 。
①所以N2的平衡转化率=(0.3-0.1)/0.3*100%=66.7%
②反应2NH3(g) ="===" N2(g) +3H2(g)的平衡常数K=" c(N2)*" c(H2)^3/ c(NH3)^2=0.005

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
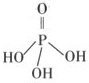
 H
H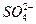 ====BaSO4↓来表示的是( )
====BaSO4↓来表示的是( )