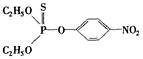
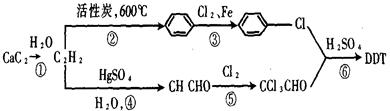
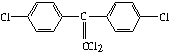
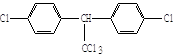题目内容
(8分)【化学—化学与技术】
碘酸钾是一种白色结晶,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘;在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560 ℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:6I2 +11KClO3 +3H2O=6KH(IO3)2 + 5KCl + 3Cl2
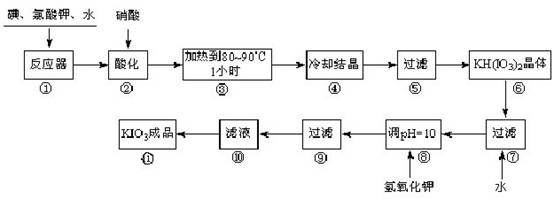
试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为___________;
(2)步骤②中,用硝酸而不用HI,其原因可能是______________________;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________;
(4)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为:________;
碘酸钾是一种白色结晶,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘;在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560 ℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:6I2 +11KClO3 +3H2O=6KH(IO3)2 + 5KCl + 3Cl2

试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为___________;
(2)步骤②中,用硝酸而不用HI,其原因可能是______________________;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________;
(4)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为:________;
(1)60(2分)
(2)HI具有还原性,能将已生成的碘酸氢钾还原(2分)
(3)Cl2 及Cl2 与KOH反应生成的KClO,能将KIO3 氧化成KIO4(2分)
(4)KH(IO3)2 + KOH = 2KIO3 + H2O(2分)
(2)HI具有还原性,能将已生成的碘酸氢钾还原(2分)
(3)Cl2 及Cl2 与KOH反应生成的KClO,能将KIO3 氧化成KIO4(2分)
(4)KH(IO3)2 + KOH = 2KIO3 + H2O(2分)
本题解题的关键是读懂题意,了解题目相关信息,运用氧化还原反应理论来解决。KIO3,既有氧化性又有还原性,这就要求在制备过程中要防氧化、防还原;且在常温稳定,高温分解,就要防高温。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 Cr2O(橙色)+H2O
Cr2O(橙色)+H2O
 曝气池
曝气池 一级沉降池
一级沉降池 二级沉降池
二级沉降池 过滤池
过滤池