题目内容
【题目】在隔绝空气的装置中,将0.2mol铁和铝的混合物溶于400ml c(H+)为2mol/L稀硫酸中,然后滴加1mol/L的NaOH溶液,请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液的体积的变化如图所示。
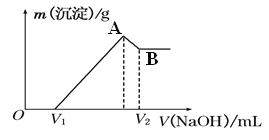
A点时溶液中的溶质有 ;此时溶液刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)= 。当V1=300ml时,金属粉末中n(Fe)= mol,V2= ml.
(2)写出AB段有关的离子方程式:
【答案】(1)Na2SO4;800ml;0.1;900
(2)Al(OH)3+OH-= AlO2-+2H2O
【解析】
试题分析:(1)加入V1mLNaOH溶液不生成沉淀,只发生酸碱中和反应,则最初加入V1mLNaOH溶液中和剩余的硫酸,A点时Fe2+、Al3+刚好沉淀完全,溶液的溶质只有Na2SO4;根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2n(H2SO4)=2×0.4L×1mol/L=0.8mol,所以V(NaOH)=0.8mol÷1L/mol=0.8L=800mL;
当V1=300mL时,此时,溶液是FeSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=1/2×n(NaOH)=1/2×0.3L×1mol/L=0.15mol。
令FeSO4为xmol,Al2(SO4)3为ymol,则:①x+2y=0.2,②x+3y=0.4×10.15,
解得①②组成的方程组得:x=0.1、y=0.05,
所以金属粉末中n(Fe)=0.1mol,n(Al)=2y=2×0.05mol=0.1mol;
滴加NaOH溶液到体积V2时,溶液是Na2SO4和NaAlO2混合液,
根据Na守恒有:n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.4L×1mol/L+0.1mol=0.9mol,
所以,V3=0.9mol÷1mol/L=0.9L=900mL。
故答案为:Na2SO4;800ml;0.1;900;
(2)AB段发生反应为氢氧化铝沉淀溶解于过量的氢氧化钠溶液中,该反应的离子方程式为:Al(OH)3+OH-= AlO2-+2H2O。