题目内容
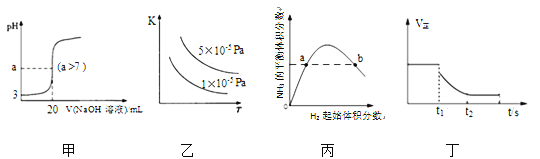
【题目】下列关于电子式的描述正确的是
A. CC14的电子式为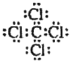
B. CaC12的电子式为![]()
C. CO2的电子式为![]()
D. 用电子式表示HCl的形成过程为![]()
【答案】A
【解析】
A. CC14分子中C原子与4个Cl形成4对共用电子对,每个原子都达到最外层8个电子的稳定结构,因此其电子式为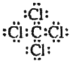 ,A正确;
,A正确;
B.CaC12是离子化合物,Ca2+与Cl-形成离子键,在离子晶体中阴、阳离子要间隔排列,故2个Cl-不能合写在一起,因此电子式为![]() ,B错误;
,B错误;
C.CO2分子中C原子与2个O原子形成4对共用电子对,使每个原子都达到最外层8个电子的稳定结构,其电子式为![]() ,C错误;
,C错误;
C.HCl是共价化合物,H原子与Cl原子间共用1对电子,形成过程表示为![]() ,D错误;
,D错误;
故合理选项是A。

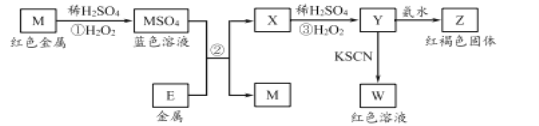
【题目】研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。

(1)仪器A的名称为________;A中反应的离子方程式为________。
(2)甲同学将A中产生的气体通入下列溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 | |
b | AgNO3溶液 | 出现白色沉淀 |
①实验a中的现象为________。
②不能证明产生的气体中含有HCl的实验是________(填字母序号)。
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因:______________________________________。
(4)已知:2S2O32-+I2=== S4O62-+2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
I.测定X中溶解的Cl2。取25.00 mL溶液X,加入过量KI溶液,然后用0.04 molL-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液V mL。
II.测定X中Cl元素总量。另取25.00 mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10 molL-1 AgNO3溶液滴定所得溶液中的Cl-。
①X中的HClO不会影响I的测定结果,原因是________。
②由I、II 中实验数据可证明A中产生的气体中含有HCl,则II中消耗0.10 molL-1 AgNO3溶液的体积应大于________mL(用含V的代数式表示)。