题目内容
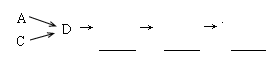
硝酸铵是含氮量较高的化肥,生产流程如下(产物水均已略去):
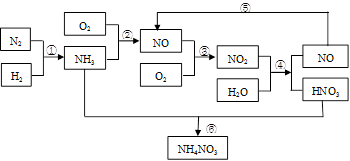
(1)反应④的化学方程式为3NO2+H2O = 2HNO3+NO,该反应的氧化剂为__________,还原剂为__________。
(2)补充并配平反应②的化学方程式:____NH3 +___O2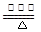 ____NO+ ________
____NO+ ________
(3)化学反应_______(填序号)是非氧化还原反应,离子方程式为_________________
(4)有人设计了一个反应来制备硝酸NO2+NH3 — HNO3+H2O(未配平),你认为该反应 (填“能”或“不能”)发生,理由是______________________。

(1)反应④的化学方程式为3NO2+H2O = 2HNO3+NO,该反应的氧化剂为__________,还原剂为__________。
(2)补充并配平反应②的化学方程式:____NH3 +___O2
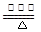 ____NO+ ________
____NO+ ________ (3)化学反应_______(填序号)是非氧化还原反应,离子方程式为_________________
(4)有人设计了一个反应来制备硝酸NO2+NH3 — HNO3+H2O(未配平),你认为该反应 (填“能”或“不能”)发生,理由是______________________。
(1)NO2、NO2;(2)4、5、4、6 H2O;(3)⑥, NH3+H+=NH4+;(4)不能,化合价只有升高,没有降低。(其他合理答案也给分)
试题分析:(1)反应④的化学方程式为3NO2+H2O = 2HNO3+NO,该反应中NO2中氮元素的化合价由反应前的+4分别变为反应后的+5价和+2价,故NO2既是氧化剂又是还原剂;(2)利用化合价升降法结合原子守恒配平反应的化学方程式为:4NH3 +5O2
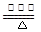 4NO+ 6H2O;答案为:4、5、4、6 H2O;(3)分析转化关系图知,化学反应⑥没有元素化合价变化,是非氧化还原反应,离子方程式为NH3+H+=NH4+;(4)分析反应中元素的化合价知,化合价只有升高,没有降低,故该反应不能发生。
4NO+ 6H2O;答案为:4、5、4、6 H2O;(3)分析转化关系图知,化学反应⑥没有元素化合价变化,是非氧化还原反应,离子方程式为NH3+H+=NH4+;(4)分析反应中元素的化合价知,化合价只有升高,没有降低,故该反应不能发生。
练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
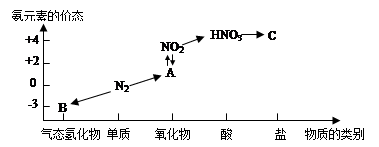

 2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大
2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大 4NO+6H2O
4NO+6H2O