题目内容
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫和铁的化合物。
(1)冶炼铜的反应为: 8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________(填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
根据以上信息回答下列问题:
a.除去Al3+的离子方程式是______________________。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为______________。证明炉渣中含有FeO的实验现象为______________________。
(1)Cu、O
(2)b、c
(3)a.Al3++4OH-=AlO2-+2H2O
b.稀硫酸、KMnO4溶液 稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
【解析】(1)分析方程式中各元素化合价可知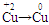 ,
,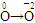 氧元素、铜元素在反应中被还原。(2)二氧化硫污染环境,不能排入空气中,浓硫酸不能吸收二氧化硫,也不能消耗二氧化硫,可以“变废为宝”制硫酸,也可以用纯碱吸收制亚硫酸钠。(3)Al3+与过量的氢氧化钠溶液反应生成偏铝酸钠溶液,而Fe3+与氢氧化钠溶液反应生成氢氧化铁沉淀,过滤,将Al3+除去。反应的离子方程式为:Al3++4OH-=AlO2-+2H2O。若要证明炉渣中含有FeO需要首先将其溶解,生成可溶性的亚铁盐,结合试剂分析可知,将该溶液加入到高锰酸钾溶液中,亚铁离子具有强还原性,因此,可以使高锰酸钾溶液褪色。选用的试剂是稀硫酸和高锰酸钾溶液。
氧元素、铜元素在反应中被还原。(2)二氧化硫污染环境,不能排入空气中,浓硫酸不能吸收二氧化硫,也不能消耗二氧化硫,可以“变废为宝”制硫酸,也可以用纯碱吸收制亚硫酸钠。(3)Al3+与过量的氢氧化钠溶液反应生成偏铝酸钠溶液,而Fe3+与氢氧化钠溶液反应生成氢氧化铁沉淀,过滤,将Al3+除去。反应的离子方程式为:Al3++4OH-=AlO2-+2H2O。若要证明炉渣中含有FeO需要首先将其溶解,生成可溶性的亚铁盐,结合试剂分析可知,将该溶液加入到高锰酸钾溶液中,亚铁离子具有强还原性,因此,可以使高锰酸钾溶液褪色。选用的试剂是稀硫酸和高锰酸钾溶液。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案








