题目内容
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。
【背景素材】
Ⅰ.NO+NO2+Ca(OH)2Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成![]() ,
, ![]() 被还原为Mn2+。
被还原为Mn2+。
Ⅲ.在酸性条件下,Ca(NO2)2能将I氧化为I2, ![]() 能将I2还原为I。
能将I2还原为I。
【制备氮氧化物】
(1)甲组同学拟利用如下图所示装置制备氮氧化物。
![]()
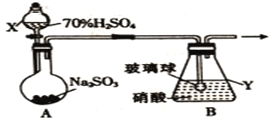
①仪器X的名称是_______________,在制备氮氧化物前要先____________________________。
②装置B中逸出的NO与NO2的物质的量之比为1∶1,则装置B中发生反应的化学方程式为____________________________________________________,若其他条件不变,增大硝酸的浓度,则会使逸出的气体中n(NO2)__________n(NO)(填“>”或“<”)。
【制备Ca(NO2)2】
(2)乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2,装置如图。
![]()
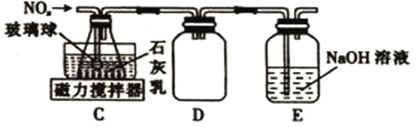
①装置C中导管末端接一多孔玻璃球的作用是______________________________________。
②装置D的作用是_______________________;装置E的作用是______________________。
【测定Ca(NO2)2的纯度】
(3)丙组同学拟用滴定法测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b.c1 mol·L1的KI溶液 c.淀粉溶液
d.c2 mol·L1的Na2S2O3溶液 e.c3 mol·L1的酸性KMnO4溶液
①利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是________________(填字母)。
②利用Ca(NO2)2的氧化性来测定其纯度的步骤:准确称取m g Ca(NO2)2样品放入锥形瓶中,加适量水溶解,加入______________________________,然后滴加稀硫酸,用c2 mol·L1的Na2S2O3溶液滴定至溶液颜色由________________________,且半分钟内不变色,读取消耗Na2S2O3溶液的体积。为减少误差,须__________________________________________(请补充完整实验步骤)。
【答案】 分液漏斗 检查装置的气密性 2SO2+2HNO3+H2ONO+NO2+2H2SO4 > 增大与石灰乳的接触面积,加快反应速率 防止倒吸(或作安全瓶) 吸收未反应的氮氧化物 e 过量c1 mol·L1的KI溶液、淀粉溶液 蓝色恰好变为无色 重复以上操作2~3次
【解析】(1) ①仪器X、Y分别是分液漏斗、锥形瓶;制备气体时一般必须先检查装置的气密性,故在制备氮氧化物前要先检查装置的气密性;②根据题意,装置B中盛放的是硝酸,二氧化硫与硝酸反应放出一氧化氮和二氧化氮,若逸出的NO与NO2的物质的量之比为1∶1,则装置B中发生反应的化学方程式为2SO2+2HNO3+H2O=NO+NO2+2H2SO4,若其他条件不变,硝酸的浓度越大,生成的二氧化氮越多,则会使逸出的气体中n(NO2)>n(NO);⑵①装置C中导管末端接一多孔玻璃球,可以增大与石灰乳的接触面积,加快反应速率;②反应中,装置内气体的压强会发生变化,装置D可以防止倒吸(或作安全瓶);装置E中的氢氧化钠可以吸收未反应的氮氧化物,防止污染空气;⑶ ①根据信息Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成NO3-,MnO4-被还原为Mn2+,利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是c3mol·L-1 的酸性 KMnO4 溶液,答案选e;②根据信息Ⅲ.在酸性条件下,Ca(NO2)2能将I-氧化为I2,S2O32-能将I2还原为I-。利用Ca(NO2)2的氧化性来测定其纯度,步骤为:准确称取m g Ca(NO2)2样品放入锥形瓶中,加适量水溶解,加入过量c1mol·L-1的KI溶液、淀粉浓液,然后滴加稀硫酸,用c2 mol·L1的Na2S2O3溶液滴定至溶液颜色由蓝色恰好变为无色,且半分钟内不变色,读取消耗Na2S2O3溶液的体积。为减少误差,须重复以上操作23次。

 优生乐园系列答案
优生乐园系列答案