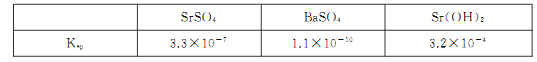
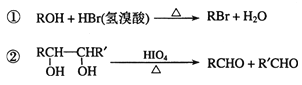
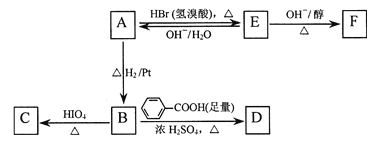
题目内容
【题目】某化学小组做完高温下铁与水蒸气反应的实验后得到一种黑色粉末。他们为探究该黑色粉末中是否有未反应完的铁粉,又进行了如下实验,装置如图1所示。请回答下列问题:
(1)铁与水蒸气反应的化学方程式是_____________________;
(2)按图1连接好仪器后,检查装置的气密性的操作方法是_______________;
(3)仪器b的名称是_____,往仪器b中加入的试剂可能是______(填一种);

(4)实验中观察到烧瓶中有气泡产生,则黑色粉末中_______(填“有”或“无”)铁粉,产生气泡的离子方程式是________________________;
(5)如果黑色粉末的质量为w g,当时实验条件下产生的气体的密度为ρg/cm3 ,多次试验求出量筒中液体平均体积为a mL,则黑色粉末中铁的氧化物的质量分数为__________________。
【答案】3Fe+4H2O(g)![]() Fe3O4+4H2 将导管末端放入水槽中,微热烧瓶,如果水槽中产生气泡,停止加热后导管末端倒吸进一段水柱,证明装置气密性良好 分液漏斗(或恒压分液漏斗) 盐酸或稀硫酸 有 Fe+2H+=Fe2++H2↑ (w-28aρ)/w
Fe3O4+4H2 将导管末端放入水槽中,微热烧瓶,如果水槽中产生气泡,停止加热后导管末端倒吸进一段水柱,证明装置气密性良好 分液漏斗(或恒压分液漏斗) 盐酸或稀硫酸 有 Fe+2H+=Fe2++H2↑ (w-28aρ)/w
【解析】
(1)铁与水蒸气反应的化学方程式是:3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。
(2)检查装置的气密性的操作方法是将导管末端放入水槽中,微热烧瓶,如果水槽中产生气泡,停止加热后导管末端倒吸进一段水柱,证明装置气密性良好。
(3)仪器b的名称是分液漏斗(或恒压分液漏斗),往仪器b中加入的试剂可能是盐酸或稀硫酸,因为铁和盐酸或稀硫酸反应生成氢气。
(4)Fe+2H+=Fe2++H2↑。
(5)氢气的密度为ρg/cm3,体积为a mL,质量为ρag,
Fe+2H+=Fe2++H2↑
56 2
x ρag
x=28ρag。
(1)高温下铁与水蒸气反应的实验后得到一种黑色粉末,是四氧化三铁,故铁与水蒸气反应的化学方程式是:3Fe+4H2O(g)![]() Fe3O4+4H2,故答案为:3Fe+4H2O(g)
Fe3O4+4H2,故答案为:3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。
(2)按图1连接好仪器后,检查装置的气密性的操作方法是将导管末端放入水槽中,微热烧瓶,如果水槽中产生气泡,停止加热后导管末端倒吸进一段水柱,证明装置气密性良好,故答案为:将导管末端放入水槽中,微热烧瓶,如果水槽中产生气泡,停止加热后导管末端倒吸进一段水柱,证明装置气密性良好。
(3)仪器b的名称是分液漏斗(或恒压分液漏斗),往仪器b中加入的试剂可能是盐酸或稀硫酸,因为铁和盐酸或稀硫酸反应生成氢气,故答案为:分液漏斗(或恒压分液漏斗);盐酸或稀硫酸。
(4)实验中观察到烧瓶中有气泡产生,产生的气泡应该是氢气,则黑色粉末中有铁粉, 离子方程式为:Fe+2H+=Fe2++H2↑,故答案为:有;Fe+2H+=Fe2++H2↑。
(5)氢气的密度为ρg/cm3,体积为a mL,质量为ρag,
Fe+2H+=Fe2++H2↑
56 2
x ρag
x=28ρag
所以铁的氧化物的质量为:w g-28ρag,质量分数为:(w-28aρ)/w×100%,
故答案为:(w-28aρ)/w。

【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是

容器 编号 | 温度/K | 起始物质的量/mol | |||
SO2 | NO | NO2 | S | ||
Ⅰ | 0.5 | 0.6 | 0 | 0 | |
Ⅱ | T1 | 0.5 | 1 | 0.5 | 1 |
Ⅲ | T2 | 0.5 | 0.2 | 1 | 1 |
A. 该反应的ΔH<0
B. T1时,该反应的平衡常数为![]()
C. 容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D. 若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数小于40%