题目内容
【题目】钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
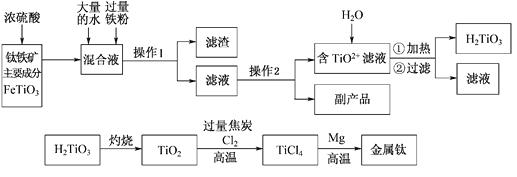
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有________________________;
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理_____________________。
(3)已知钛的还原性介于铝与锌之间。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是___________________________________。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是_____________________________________。
(5)为测定溶液中TiOSO4的含量,先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用______________________(填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。滴定终点时的现象是________________________________________________。
【答案】漏斗、玻璃棒 溶液中存在平衡:TiO2++2H2O ![]() H2TiO3+2H+,当加入水稀释、升温后,平衡正向移动 TiCl4+4Na
H2TiO3+2H+,当加入水稀释、升温后,平衡正向移动 TiCl4+4Na![]() Ti+4NaCl TiO2 + 4e- = Ti + 2O2- 酸式滴定管 溶液由无色变成红色且半分钟不褪色
Ti+4NaCl TiO2 + 4e- = Ti + 2O2- 酸式滴定管 溶液由无色变成红色且半分钟不褪色
【解析】
(1)操作1为过滤,用到的玻璃仪器除烧杯外还有,玻璃棒、漏斗;
(2)TiO2+在溶液中会发生水解反应TiO2++2H2O ![]() H2TiO3+2H+,加水稀释并加热含TiO2+的溶液,会使TiO2+的水解不断正向移动;
H2TiO3+2H+,加水稀释并加热含TiO2+的溶液,会使TiO2+的水解不断正向移动;
(3)若要还原四氯化钛,则需选择金属活动性强于钛的金属来代替镁,因此在三种金属中只能选择Na,反应方程式为TiCl4+4Na![]() Ti+4NaCl;
Ti+4NaCl;
(4)阴极上TiO2得电子生成Ti,电极反应式是TiO2 + 4e- = Ti + 2O2-;
(5)FeCl3溶液中三价铁离子水解使溶液显酸性,因此要选择酸性滴定管来进行滴定;三价铁离子能使KSCN溶液变为血红色,而反应后生成的二价铁离子则不能出现此现象,因此滴定终点时的现象是:溶液由无色变成红色且半分钟不褪色。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
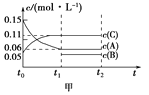
ABC考王全优卷系列答案【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。

容器 | 甲 | 乙 | 丙 |
容积 | 1L | 1L | 2L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是
A. 由图可知T1<T2,且该反应为吸热反应
B. 前10min内甲、乙、丙三个容器中反应的平均速率:v(A)乙<v(A)甲< v(A)丙
C. 平衡时A的转化率a:a乙<a甲<a丙
D. T1时该反应的平衡常数K=7.2