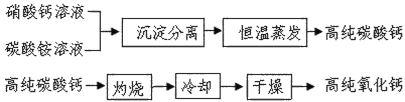
题目内容
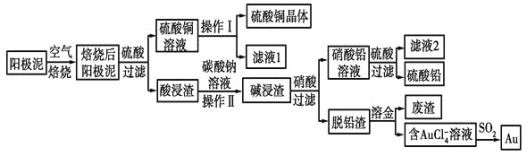
【题目】钒被称为“工业味精”“工业维生素”,在发展现代工业、国防等方面发挥着至关重要的作用。某高铬型钒渣含![]() 等物质,从中分离提取钒铬的工艺流程如下:
等物质,从中分离提取钒铬的工艺流程如下:
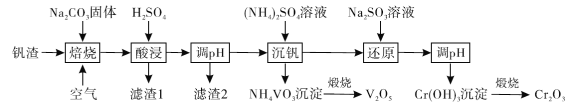
回答下列问题:
(1)“焙烧”时会生成![]() 和
和![]() ,生成
,生成![]() 的化学方程式是_________________________。
的化学方程式是_________________________。
(2)滤渣1中主要含_________________。滤渣2的主要成分是![]() 和
和![]() ,要使所得滤液中含有的相关金属离子浓度小于
,要使所得滤液中含有的相关金属离子浓度小于![]() ,应调
,应调![]() 不低于___。(已知:
不低于___。(已知:![]()
![]()
(3)“沉钒”所用![]() 溶液中,离子浓度由大到小的顺序是_________________________。
溶液中,离子浓度由大到小的顺序是_________________________。
(4)“还原”时溶液的![]() 在2.5左右,此时控制酸度应选用_______________(填字母标号)。
在2.5左右,此时控制酸度应选用_______________(填字母标号)。
A.稀盐酸 B.稀硫酸 C.稀硝酸 D.硫酸铵
(5)![]() 煅烧时发生反应的类型是否相同?____________(填“相同”或“不同”)
煅烧时发生反应的类型是否相同?____________(填“相同”或“不同”)
(6)工业上可用电解还原法处理含![]() 的酸性废水。用铁板作阳极,电解过程中,废水
的酸性废水。用铁板作阳极,电解过程中,废水![]() 逐渐上升
逐渐上升![]() 都以氢氧化物沉淀析出,达到废水净化的目的。
都以氢氧化物沉淀析出,达到废水净化的目的。
①其中阳极的电极反应式是_________________________。
②电解过程中,废水![]() 上升的原因是________________________________________________。
上升的原因是________________________________________________。
【答案】 硅酸 5
硅酸 5 ![]() B 相同
B 相同 ![]() 溶液中发生反应
溶液中发生反应![]() 消耗
消耗![]() ,同时阴极
,同时阴极![]() 放电也被消耗
放电也被消耗
【解析】
在通入空气条件下,二氧化硅和碳酸钠反应得到硅酸钠,![]() 将被完全氧化为
将被完全氧化为![]() ,
,![]() 则和碳酸钠转化为
则和碳酸钠转化为![]() ,
,![]() 中+3价的铬被氧化成+6价的
中+3价的铬被氧化成+6价的![]() ,加入硫酸酸浸,硅酸钠转变为硅酸白色沉淀,同时
,加入硫酸酸浸,硅酸钠转变为硅酸白色沉淀,同时![]() 、
、![]() 、
、![]() 、
、![]() 皆溶于酸得到
皆溶于酸得到![]() 、
、![]() 、
、![]() 、
、![]() 四种离子,调pH使
四种离子,调pH使![]() 、
、![]() 转化为
转化为![]() 和
和![]() 析出;接下来用硫酸铵溶液“沉钒”,加入亚硫酸钠的目的是为了还原
析出;接下来用硫酸铵溶液“沉钒”,加入亚硫酸钠的目的是为了还原![]() ,将其转变为+3价的
,将其转变为+3价的![]() 后调pH析出,据此来分析本题即可。
后调pH析出,据此来分析本题即可。
(1)注意反应物中除![]() 和碳酸钠外还有一种氧化剂(氧气),否则无法配平,方程式
和碳酸钠外还有一种氧化剂(氧气),否则无法配平,方程式 ;
;
(2)根据分析,滤渣1中主要含硅酸;根据二者的溶度积可以发现![]() 的溶解度更小,因此只要使
的溶解度更小,因此只要使![]() 完全沉淀,
完全沉淀,![]() 就会完全沉淀,将
就会完全沉淀,将![]() 代入
代入![]() 的溶度积,解得
的溶度积,解得![]() ,即当pH为5时,
,即当pH为5时,![]() 和
和![]() 完全沉淀;
完全沉淀;
(3)水解是微弱的,而电离是完全进行的,因此硫酸铵溶液中![]() ,
,![]() 水解导致溶液呈酸性,因此
水解导致溶液呈酸性,因此![]() ,综上有
,综上有![]() ;
;
(4)A.![]() 氧化性较强,可以将
氧化性较强,可以将![]() 氧化,因此不能使用稀盐酸,A项错误;
氧化,因此不能使用稀盐酸,A项错误;
B.硫酸较稳定,可以用来调节pH,B项正确;
C.硝酸具有强氧化性,会消耗亚硫酸钠,C项错误;
D.硫酸铵溶液尽管因水解而显酸性,但是酸性较弱无法达到要求,D项错误;
答案选B;
(5)![]() 受热分解得到
受热分解得到![]() 、
、![]() 和
和![]() ,而
,而![]() 受热分解得到
受热分解得到![]() 和
和![]() ,两个反应均为分解反应,因此反应类型相同;
,两个反应均为分解反应,因此反应类型相同;
(6)阳极使用的铁板不是惰性电极,因此失电子:![]() ,产生的
,产生的![]() 具有很强的还原性,和
具有很强的还原性,和![]() 发生氧化还原反应:
发生氧化还原反应:![]() ,同时阴极
,同时阴极![]() 得电子产生氢气,综上,溶液中的
得电子产生氢气,综上,溶液中的![]() 被消耗导致浓度降低,最终溶液的pH增大。
被消耗导致浓度降低,最终溶液的pH增大。

 阅读快车系列答案
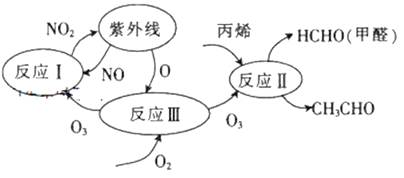
阅读快车系列答案【题目】某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
(甲同学的实验)
装置 | 编号 | 试剂X | 实验现象 |
| I | Na2SO3溶液(pH≈9) | 闭合开关后灵敏电流计指针发生偏转 |
II | NaHSO3溶液(pH≈5) | 闭合开关后灵敏电流计指针未发生偏转 |
(1)怎样配制FeCl3溶液? ________________________________________________________。
(2)甲同学探究实验I的电极产物。
① 取少量Na2SO3溶液电极附近的混合液,加入_________________________________,产生白色沉淀,证明产生了SO42-。
② 该同学又设计实验探究另一电极的产物,其实验方案为_______________________________。
(3)实验I中负极的电极反应式为______________________________________________________。
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
装置 | 编号 | 反应时间 | 实验现象 |
| III | 0~1 min | 产生红色沉淀,有刺激性气味气体逸出 |
1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | ||
30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3HSO3-![]() Fe(OH)3 +3SO2;②_____________________________________________。
Fe(OH)3 +3SO2;②_____________________________________________。
![]()
从反应速率和化学平衡两个角度解释1~30 min的实验现象:______________________________。
(实验反思)
(6)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和______________________有关(写出两条)。
【题目】乙烯是重要的有机化工原料,可由乙醇脱水制备。涉及反应如下:
①2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
②2CH3OH(g)![]() C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
③CH3CH2OH(g)![]() CH3OCH3(g) △H3= +50.7kJmol-1
CH3OCH3(g) △H3= +50.7kJmol-1
④C2H5OH(g)![]() C2H4(g)+ H2O(g) △H4=akJmol-1
C2H4(g)+ H2O(g) △H4=akJmol-1
回答下列问题:
(1)a=___________。
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①欲提高C2H5OH的平衡转化率,应采取的措施为___________(填字母)。
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为_________,平衡时C2H5OH的转化率为_______(结果保留两位有效数字,下同),该反应的平衡常数K=_________。
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=_____mol,n(C2H5OH)=_____mol。
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是______,由此规律推出反应在12h时c(C2H5OH)等于______molL-1
反应时间t/h | 0 | 4 | 8 | 16 |
c(C2H5OH)/(molL-1) | 0.10 | 0.051 | 0.026 | 0.0065 |
【题目】请按要求回答下列问题:
(1)氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。已知:2C(s)+O2(g)=2CO(g)△H=-22lkJ/mol,
C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,
N2(g)+O2(g)=2NO(g)△H=+181 kJ/mol,
则:2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H=__kJ/mol;
N2(g)+2CO2(g)△H=__kJ/mol;
下列措施能够增大此反应中NO的转化率的是___(填字母序号)
a.增大容器的体积 b.降低温度 c.增大CO的浓度 d.增大NO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.20 | 0.70 | 0.70 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.40 | 0.65 | 0.65 | 0.75 | 0.80 | 0.80 |
①0~5min内,以NO表示的该反应速率υ(NO)=__________,该条件下的平衡常数K=___________(保留2位小数)。
②第15min后,温度调整到T2,数据变化如上表所示,则T1___________T2(填“>”、“<”或“=”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-6mol·L-1)时,溶液中c(Ag+)为__mol·L-1,此时溶液中c(CrO42-)等于____mol·L-1。(已知Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=2.0×10-10)。