题目内容
已知X、Y、Z、M、W、R是前四周期中的六种元素。X元素原子形成的离子是一个质子,Y原子的价电子构型为2s22p2,Z的单质在常温下是无色气体且Z原子的单电子个数是同周期元素原子中最多的。
(1) 24R原子最外层的电子排布图是 ,ZO3-的空间构型是 ;
(2) Z、M、W原子序数依次增大,三种元素的第一电离能由大到小的顺序是 ;Y、Z、W三种元素的电负性由大到小的顺序是 。(填元素符号)
(3) Ne与Wn-的电子数相同,W所在族的各元素的氢化物的水溶液均显酸性,则该族元素的氢化物中沸点最低的是 。(填化学式)
(4)ZX4W在物质中,各种粒子间的相互作用力包括 。(填字母编号)
(1) 24R原子最外层的电子排布图是 ,ZO3-的空间构型是 ;
(2) Z、M、W原子序数依次增大,三种元素的第一电离能由大到小的顺序是 ;Y、Z、W三种元素的电负性由大到小的顺序是 。(填元素符号)
(3) Ne与Wn-的电子数相同,W所在族的各元素的氢化物的水溶液均显酸性,则该族元素的氢化物中沸点最低的是 。(填化学式)
(4)ZX4W在物质中,各种粒子间的相互作用力包括 。(填字母编号)
| A.非极性共价键 | B.极性共价键 | C.配位键 | D.离子键 E.氢键 |
(1)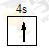 平面三角形 (2)F>N>O F>N>C(3)HCl(4)BCD
平面三角形 (2)F>N>O F>N>C(3)HCl(4)BCD
 平面三角形 (2)F>N>O F>N>C(3)HCl(4)BCD
平面三角形 (2)F>N>O F>N>C(3)HCl(4)BCD试题分析: 质子为H+,X是H;由Y的价电子排布式得Y是C;Z单质是无色气体且Z原子单电子个数同周期原子中最多可推出Z为N。
(1)R原子序数为24,R为Cr,价电子排布式为3d54s1,最外层只有1个电子。NO3-中N价层电子对数=
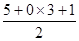 =3,N周围有3对电子对,无孤对电子,NO3-为平面三角形。
=3,N周围有3对电子对,无孤对电子,NO3-为平面三角形。(2)Z、M、W原子序数依次增大,所以Z、M、W分别为N、O、F。同周期元素从左向右,第一电离能总体趋势增大,IIA和VA反常,第一电离能:F>N>O;同周期元素(0族元素除外)从左向右,电负性增大,电负性:F>N>C。
(3)同族元素氢化物水溶液均呈酸性的是VIIA族,因HF存在分子间氢键,沸点反常地高,沸点:HF>HI>HBr>HCl。
(4)NH4F中NH4+与F-以离子键结合;NH4+中,三个H与N形成共价键,一个H与N形成配位键。

练习册系列答案
相关题目
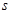 键与π键的键数之比为 。
键与π键的键数之比为 。