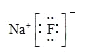题目内容
【题目】1871年门捷列夫最早预言了类硅元素锗,1886年德国化学家温克勒发现和分离了锗元素,并以其祖国的名字命名为“Ge”。锗是重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。下图为工业上利用锗锌矿(主要成分GeO2和ZnS)来制备高纯度锗的流程。
已知:1.丹宁是一种有机沉淀剂,可与四价锗络合形成沉淀;2.GeCl4易水解,在浓盐酸中溶解度低。

(1)简述步骤①中提高酸浸效率的措施___________(写两种)。
(2)步骤②操作A方法是___________。
(3)步骤③中的物质在___________(填仪器名称)中加热。
(4)步骤④不能用稀盐酸,原因可能是___________。
(5)写出步骤⑤的化学方程式___________。写出步骤⑦的化学方程式___________。
(6)请写出一种证明步骤⑦反应完全的操作方法___________。
【答案】把矿石粉碎;加热;充分搅拌 过滤 坩埚 防止四价锗水解;防止GeO2不能充分反应;有利于GeCl4析出 GeCl4+(2+n)H2O=GeO2·nH2O+4HCl GeO2+2H2![]() Ge+2H2O 将反应生成的气体通入装有无水硫酸铜的U形管,无现象(其他合理组合亦可)
Ge+2H2O 将反应生成的气体通入装有无水硫酸铜的U形管,无现象(其他合理组合亦可)
【解析】
锗锌矿在酸浸取下生成四价锗,再被有机沉淀剂沉淀,。沉淀经灼烧得到GeO2,再与浓盐酸反应得到GeCl4,其发生水解,得到GeO2·nH2O,脱水得到GeO2。从得到粗品的GeO2再得到高纯度的GeO2的整个过程,是为了提高GeO2的纯度,最后得到高纯度的Ge。
(1)提高酸浸速率,即提高化学反应速率,可以通过粉碎矿石增大矿石与酸的接触面积、适当的提高温度,搅拌等等,答案为把矿石粉碎;加热;充分搅拌;
(2)根据流程图,经过操作A之后,得到了沉淀和滤液,所以操作A为过滤,答案为过滤;
(3) 步骤③为焙烧,固体加热需要用到坩埚,答案为坩埚;
(4)根据已知GeCl4易水解,而且在浓盐酸中溶解度低,能沉淀,易分离。如果用稀盐酸,GeCl4会水解,而且在稀盐酸中的溶解度较大不利于析出,而且要确保GeO2完全反应成GeCl4。答案为防止四价锗水解;防止GeO2不能充分反应;有利于GeCl4析出;
(5)步骤⑤,GeCl4和纯水反应生成GeO2·nH2O,为水解反应。步骤⑦,GeO2为H2还原得到Ge。答案为GeCl4+(2+n)H2O=GeO2·nH2O+4HCl GeO2+2H2![]() Ge+2H2O;
Ge+2H2O;
(6) 步骤⑦反应完全从Ge或者GeO2不易看出现象,可以从成物水分析,可以通过检验气体中是否含水来验证是否反应完,通常用无水硫酸铜检验水蒸气的存在。答案为将反应生成的气体通入装有无水硫酸铜的U形管,无现象(其他合理组合亦可);

 阅读快车系列答案
阅读快车系列答案【题目】当发动机工作时,反应产生的NO尾气是主要污染物之一,NO的脱除方法和转化机理是当前研究的热点。请回答下列问题:
(1)已知:2NO(g)+O2 (g) =2NO2(g) △H1= -113kJ/mol
6NO2(g)+O3(g)=3N2O5(g) △H2= -227 kJ/mol
4NO2 (g)+O2(g)=2N2O5(g) △H3= -57 kJ/mol
则 2O3(g)= 3O2(g)是_________反应(填“放热”或“吸热”),以上 O3氧化脱除氮氧化物的总反应是NO(g)+O3(g)=NO2(g)+O2(g) △H4=_______kJ/mol,最后将NO2与_________剂反应转化为无污染的气体而脱除。
步骤 | 反应 | 活化能 | 正反应速率方程 | 逆反应速率方程 |
I | 2NO(g) | Ea1 |
|
|
II | N2O2(g)+O2(g) | Ea2 |
|
|
(2)已知:2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①表中k1、k2、k3、k4是只随温度变化的常数,温度升高将使其数值_____(填“增大”或“减小”)。
②反应I瞬间建立平衡,因此决定2NO(g)+O2(g)![]() 2NO2(g)反应速率快慢的是反应II,则反应I与反应II的活化能的大小关系为Ea1____Ea2(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因______________________________________________。
2NO2(g)反应速率快慢的是反应II,则反应I与反应II的活化能的大小关系为Ea1____Ea2(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因______________________________________________。
③一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)的速率方程为
2NO2(g)的速率方程为![]() ,则k=_______ (用k1、k2、k3表示)。
,则k=_______ (用k1、k2、k3表示)。
(3)将一定量的 NO2放入恒容密闭容器中发生下列反应:2NO2(g) ![]() 2NO(g)+O2(g),测得其平衡转化率α(NO2)随温度变化如图所示,从 b 点到 a 点降温平衡将向_____移动。图中 a点对应温度下,NO2的起始压强为 160kPa,该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
2NO(g)+O2(g),测得其平衡转化率α(NO2)随温度变化如图所示,从 b 点到 a 点降温平衡将向_____移动。图中 a点对应温度下,NO2的起始压强为 160kPa,该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)

【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-