题目内容
【题目】古代硫酸的制法是隔绝空气锻烧绿矾(FeSO47H2O),将蒸气冷却可制得一种无色粘稠的液体“绿矾油”,剩余的固体为红棕色。已知SO3的熔点是16.8°C,沸点是44.8°C,在加热条件下SO3具有比较强的氧化性。完成下列各空:
(1)绿矾油中溶质的化学式为_________。
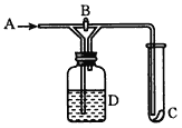
(2)用下图装置煅烧绿矾并检验气体产物,煅烧一段时间后,发现D中U型管出现无色粘稠的液体,B中品红溶液褪色。

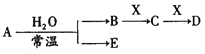
① 上述装置正确的连接顺序是A→(_______________________)(用大写字母表示)。
② 写出煅烧绿矾的化学方程式_________。
(3)绿矾在空气中部分被氧化为硫酸铁,现取3.66g绿巩样品溶于稀盐酸,加人足贵的BaCl2溶液,过滤得沉淀4.66g,向溶液中通入56mL(标准状况)氯气恰好将Fe2+完全氧化,计算变质后的绿矾晶体中n(Fe3+):n(Fe2+)为_________。
【答案】 H2SO4 D→(E)→B→C 2FeSO4·7H2O △ Fe2O3+SO3↑+SO2↑+14H2O↑((或 2FeSO4·7H 2O △ Fe2 O3 + H2SO4 +SO2 ↑+13H2O↑ ) 2∶1
【解析】试题分析:锻烧绿矾(FeSO4 7H2O),将蒸气冷却可制得一种无色粘稠的液体“绿矾油”,剩余的固体为红棕色,可知生成氧化铁、SO3、水,根据氧化还原反应规律,铁元素化合价升高,硫元素化合价降低,所以还有SO2生成;根据原子守恒、电子守恒化学方程式为![]() ;根据
;根据![]() 计算硫酸根离子的物质的量,根据消耗氯气的物质的量计算 n(Fe2+),根据电荷守恒可知n(Fe3+)。
计算硫酸根离子的物质的量,根据消耗氯气的物质的量计算 n(Fe2+),根据电荷守恒可知n(Fe3+)。
解析:(1) 根据以上分析,SO3与水反应生成硫酸,所以绿矾油中溶质的化学式为H2SO4。
(2)① 品红溶液检验SO2,氢氧化钠吸收SO2,防止污染,E是安全瓶,防倒吸,正确的连接顺序是A→D→(E)→B→C。
②煅烧绿矾的化学方程式![]() 。
。
(3) 设硫酸根离子的物质的量为xmol

X=0.02mol;设 n(Fe2+)=ymol
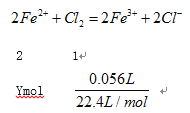
Y=0.005mol,根据元素守恒n(Fe3+)=(0.02mol-0.005)÷3×2=0.01,n(Fe3+):n(Fe2+)=2:1。