题目内容
4.已知醋酸达到电离平衡后,改变某条件电离平衡向正反应方向移动,则下列说法正确的是( )| A. | 实现该变化的只能是升高温度 | B. | 溶液的导电能力一定变强 | ||
| C. | 溶液的pH一定减小 | D. | 发生电离的分子总数增多 |
分析 A、升高温度或加水都能使电离平衡向正反应方向;
B、加醋酸钠,溶液中离子浓度增大,导电性增强;
C、若改变条件为加水,则促进电离,但氢离子的浓度减小;
D、电离平衡向正反应方向移动,发生电离的分子总数增多.
解答 解:A、弱酸的电离为吸热过程,升高温度,加水促进电离,所以电离平衡正向移动,故A错误;
B、加醋酸钠,溶液中离子浓度增大,导电性增强,醋酸钠电离出的醋酸根离子抑制醋酸的电离,电离平衡向逆反应方向移动,故B错误;
C、因升高温度或加水都能使电离平衡正向移动,若为加水,电离程度增大,生成氢离子的物质的量增大,但氢离子的浓度减小,pH增大,故C错误;
D、电离平衡向正反应方向移动,则发生电离的分子总数增多,故D正确;
故选D.
点评 本题考查醋酸的电离平衡移动,明确温度和加水对醋酸电离平衡的影响是解答本题的关键,并注意稀释时电离程度增大,但离子浓度减小来解答即可,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.向密度为d g•cm-3的盐酸中逐滴加入硝酸银溶液到过量,生成沉淀的质量与原盐酸的质量相等,原盐酸的物质的量浓度为( )
| A. | 25.4d mol•L-1 | B. | 12.7d mol•L-1 | C. | 6.97d mol•L-1 | D. | 6.35d mol•L-1 |
12.某烃的结构简式为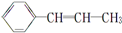 ,它可能具有的性质是( )
,它可能具有的性质是( )
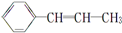 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 1 mol该烃含有4 mol碳碳双键 | |
| C. | 能发生聚合反应,其产物可表示为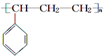 | |
| D. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 |
19.下列离子方程式书写错误的是( )
| A. | 在NaHSO4溶液中加Ba(OH)2至中性:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$=BaSO4↓+2H2O | |
| B. | 向硫酸铜溶液中通入H2S气体:Cu2++H2S═CuS↓+2H+ | |
| C. | SO2气体通入Ba(OH)2溶液中:SO2+2OH-═SO${\;}_{3}^{2-}$ | |
| D. | 用稀硫酸酸化硫化钠和亚硫酸钠的混合溶液:SO${\;}_{3}^{2-}$+2S2-+6H+═3S↓+3H2O |
9.可以用浓磷酸代替浓硫酸制取溴化氢气体的理由是( )
| A. | 浓磷酸与浓硫酸的性质相似 | |
| B. | 浓磷酸与浓硫酸一样难挥发,且属非氧化性酸 | |
| C. | 浓磷酸无氧化性,只有还原性 | |
| D. | 浓磷酸的酸性强于氢溴酸 |
16.下列物质中,发生消去反应生成的烯烃只有一种的是( )
①2丁醇
②2甲基2丙醇
③1丁醇
④2甲基2丁醇.
①2丁醇
②2甲基2丙醇
③1丁醇
④2甲基2丁醇.
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
13.下列比较不正确的是( )
| A. | 非金属性:C>N | B. | 酸性:HClO4>H2CO3 | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 热稳定性H2O>H2S |