题目内容
9.可以用浓磷酸代替浓硫酸制取溴化氢气体的理由是( )| A. | 浓磷酸与浓硫酸的性质相似 | |
| B. | 浓磷酸与浓硫酸一样难挥发,且属非氧化性酸 | |
| C. | 浓磷酸无氧化性,只有还原性 | |
| D. | 浓磷酸的酸性强于氢溴酸 |
分析 HBr属于挥发性酸,可以用难挥发性酸与NaBr制备,浓硫酸能氧化HBr,据此分析.
解答 解:HBr属于挥发性酸,可以用难挥发性酸与NaBr制备,浓磷酸具有属于难挥发性酸,没有强氧化性;浓磷酸具有难挥发性和强氧化性,能氧化HBr;可以用浓磷酸代替浓硫酸制取溴化氢,是因为浓磷酸与浓硫酸一样难挥发,且属非氧化性酸,故B正确;
故选B.
点评 本题考查了难挥发性制备易挥发酸,题目难度不大,注意把握浓硫酸和浓磷酸的性质以及性质的差别.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
19.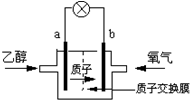 美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
 美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )| A. | a极为电池的负极 | |
| B. | 电池工作时电流由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:2H++O2+4e-═H2O | |
| D. | 电池工作时1mol乙醇被氧化时就有6mol电子转移 |
17.如图所示的钢铁腐蚀中,下列说法正确的是( )
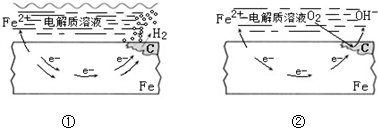

| A. | ①、②中的Fe都发生的是还原反应 | |
| B. | ①表面的电解质溶液可以为NaCl溶液 | |
| C. | 生活中钢铁制品的腐蚀以图①所示为主 | |
| D. | 图②中,正极反应式为O2+4e-+2H2O═4OH- |
4.已知醋酸达到电离平衡后,改变某条件电离平衡向正反应方向移动,则下列说法正确的是( )
| A. | 实现该变化的只能是升高温度 | B. | 溶液的导电能力一定变强 | ||
| C. | 溶液的pH一定减小 | D. | 发生电离的分子总数增多 |
14.关于钠元素的单质及其化合物的叙述正确的是( )
| A. | 用洁净的铂丝蘸取样品在无色火焰上灼烧看见黄色火焰,说明样品中不含钾元素 | |
| B. | 钠可从硫酸铜溶液中置换出铜 | |
| C. | Na2O和Na2O2都是碱性氧化物 | |
| D. | Na2O2中阴离子的摩尔质量是32g•mol-1 |
18.运动时随着汗液会流失大量盐分,如果只补充纯净水会进一步加重体内电解质紊乱.此时最好喝一些( )
| A. | 食醋 | B. | 食盐水 | C. | 啤酒 | D. | 茶水 |
19.下列说法正确的是( )
| A. | 摩尔是一种国际基本物理量 | |
| B. | 标准状况下气体摩尔体积约为22.4 L | |
| C. | 在同温同压下,相同体积的任何单质所含分子数相同 | |
| D. | 1 mol氧原子的质量为16 g |