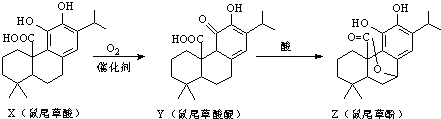
题目内容
【题目】碳及其化合物应用广泛.I.工业上利用CO和水在沸石分子筛表面反应制氢气,CO(g)+H2O(g)CO2(g)+H2(g)
(1)向1L恒容密闭容器中注入CO和H2O(g),830°C时,测得部分数据如下表.
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(CO)/mol | 0.200 | 0.160 | 0.125 | 0.099 | 0.080 | 0.080 |
n(H2O)/mol | 0.300 | 0.260 | 0.225 | 0.199 | 0.180 | 0.180 |
则该温度下反应的平衡常数K=
(2)相同条件下,向 1L恒容密闭容器中,同时注入1molCO、1molH2O(g)、2molCO2和2molH2 , 此时v(正)v(逆)(填“>”“=”或“<”);II.已知:CO(g)+ ![]() O2(g)=CO2(g)△H1=﹣141kJmol﹣1
O2(g)=CO2(g)△H1=﹣141kJmol﹣1
2H2(g)+O2(g)=2H2O(g)△H2=﹣484kJmol﹣1
CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(g)△H3=﹣726kJmol﹣1
O2(g)=CO2(g)+2H2O(g)△H3=﹣726kJmol﹣1
(3)利用CO、H2化合制得液态甲醇的热化学方程式为
(4)Ⅲ.一种新型氢氧燃料电池工作原理如图所示.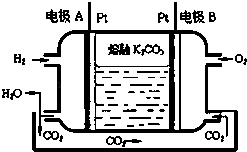
写出电极A的电极反应式放电过程中,溶液中的CO32﹣将移向电极(填A或B)
(5)以上述电池电解饱和食盐水,若生成0.2mol Cl2 , 则至少需通入O2的体积为L(标准状况)
【答案】
(1)1
(2)<
(3)CO(g)+2H2(g)=CH3OH(l)△H=+101 kJ/mol
(4)H2﹣2e﹣+CO32﹣=CO2+H2O;A
(5)2.24
【解析】解:(1)分析图表数据,4min达到平衡状态, CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始量(mol/L) 0.2 0.3 0 0
变化量(mol/L) 0.12 0.12 0.12 0.12
平衡量(mol/L) 0.08 0.18 0.12 0.12
K= ![]() =1,所以答案是:1;(2)相同条件下,向1L恒容密闭容器中,同时注人1mol CO、1mol H2O(g),2mol CO2和2mol H2 , 浓度商Q=
=1,所以答案是:1;(2)相同条件下,向1L恒容密闭容器中,同时注人1mol CO、1mol H2O(g),2mol CO2和2mol H2 , 浓度商Q= ![]() =4>K=1,反应逆向进行,此时v(正 )<v(逆),所以答案是:<;(3)已知CO(g)+
=4>K=1,反应逆向进行,此时v(正 )<v(逆),所以答案是:<;(3)已知CO(g)+ ![]() O2(g)CO2(g)△H=﹣141kJmol﹣1 ①2H2(g)+O2(g)2H2O(g)△H=﹣484kJmol﹣1 ②CH3OH(l)+
O2(g)CO2(g)△H=﹣141kJmol﹣1 ①2H2(g)+O2(g)2H2O(g)△H=﹣484kJmol﹣1 ②CH3OH(l)+ ![]() O2(g)CO2(g)+2H2O(g)△Hl=﹣726kJmol﹣1 ③依据盖斯定律①+②﹣③得到CO、H2化合制得液态甲醇的热化学方程式:CO(g)+2H2(g)=CH3OH(l)△H=+101 kJ/mol,所以答案是:CO(g)+2H2(g)=CH3OH(l)△H=+101 kJ/mol;(4)装置图是氢氧燃料电池,电解质为碳酸钾熔融盐,传导离子为碳酸根离子;依据原电池原理可知电极A为负极,氢气失电子在碱溶液中生成水,A电极反应为:H2﹣2e﹣+CO32﹣=CO2+H2O;B为正极氧气得到电子生成氢氧根离子O2+2H2O+4e﹣=4OH﹣ , CO32﹣在A极放电,CO32﹣移向A极,所以答案是:H2﹣2e﹣+CO32﹣=CO2+H2O;A;(5)电池电解饱和食盐水,阳极生成0.2mol Cl2 , 电极反应2Cl﹣﹣2e﹣=CL2↑,原电池中B为正极氧气得到电子生成氢氧根离子O2+2H2O+4e﹣=4OH﹣ , 依据电子守恒得到氯气和氧气的定量关系:2CL2~O2 , 生成氧气0.1mol,则至少需通人O2的体积标准状况下为2.24L,所以答案是:2.24.
O2(g)CO2(g)+2H2O(g)△Hl=﹣726kJmol﹣1 ③依据盖斯定律①+②﹣③得到CO、H2化合制得液态甲醇的热化学方程式:CO(g)+2H2(g)=CH3OH(l)△H=+101 kJ/mol,所以答案是:CO(g)+2H2(g)=CH3OH(l)△H=+101 kJ/mol;(4)装置图是氢氧燃料电池,电解质为碳酸钾熔融盐,传导离子为碳酸根离子;依据原电池原理可知电极A为负极,氢气失电子在碱溶液中生成水,A电极反应为:H2﹣2e﹣+CO32﹣=CO2+H2O;B为正极氧气得到电子生成氢氧根离子O2+2H2O+4e﹣=4OH﹣ , CO32﹣在A极放电,CO32﹣移向A极,所以答案是:H2﹣2e﹣+CO32﹣=CO2+H2O;A;(5)电池电解饱和食盐水,阳极生成0.2mol Cl2 , 电极反应2Cl﹣﹣2e﹣=CL2↑,原电池中B为正极氧气得到电子生成氢氧根离子O2+2H2O+4e﹣=4OH﹣ , 依据电子守恒得到氯气和氧气的定量关系:2CL2~O2 , 生成氧气0.1mol,则至少需通人O2的体积标准状况下为2.24L,所以答案是:2.24.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案