题目内容
【题目】X、Y、Z、M、N为短周期的第五种主族元素。其中X、Z同主族,Y、Z同周期,M与X、Y既不同主族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)X元素位于元素周期表的位置是第 周期,第 族
(2)请写出下列反应的离子方程式:N单质与氢氧化钠溶液反应:
(3)Y与Z相比,非金属性较强的元素的原子结构示意图为 ,可以证明该结论的实验是(用离子方程式表示) 。
(4)请将X、Z、M、N元素原子半径从大到小排序: (用元素符号表示)
【答案】(1)X是第2周期,第VIA族;
(2)Si+2OH-+H2O=SiO32-+2H2↑;
(3)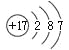 ;Cl2+S2-=2Cl-+S↓;
;Cl2+S2-=2Cl-+S↓;
(4)Si>S>O>H(硅>硫>氧>氢)。
【解析】试题分析:X、Y、Z、M、N为短周期的五种主族元素,X原子最外层电子数是核外电子层数的三倍,原子只能有2个电子层,最外层电子数为6,则X为O元素;X、Z同主族,则Z为S元素;Y的最高化合价与其最低化合价的代数和等于6,处于ⅦA族,且Y、Z同周期,则Y为Cl;N是短周期主族元素中原子半径最大的非金属元素,则N为Si;M与X、Y既不同族,也不同周期,则M为H元素。(1)X元素是O元素,位于元素周期表的位置是第2周期,第VIA族;(2)Si可以与NaOH溶液发生反应,产生Na2SiO3和氢气,反应的离子方程式是:Si+2OH-+H2O=SiO32-+2H2↑;(3) Y是Cl,Z是 S,二者是同一周期的元素,元素的非金属性Cl>S,则较强的元素的原子结构示意图为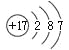 ,活动性强的可以把活动性弱的从化合物中置换出来,可以证明该结论的实验是Cl2+S2-=2Cl-+S↓。(4)同一周期的元素,原子序数越大,原子半径越小;不同周期的元素,原子核外电子层数越多,原子半径就越大,所以X、Z、M、N元素原子半径从大到小排序是Si>S>O>H。
,活动性强的可以把活动性弱的从化合物中置换出来,可以证明该结论的实验是Cl2+S2-=2Cl-+S↓。(4)同一周期的元素,原子序数越大,原子半径越小;不同周期的元素,原子核外电子层数越多,原子半径就越大,所以X、Z、M、N元素原子半径从大到小排序是Si>S>O>H。

 阅读快车系列答案
阅读快车系列答案