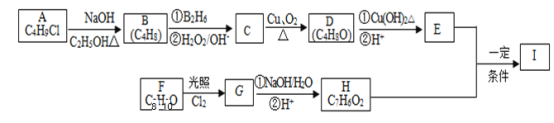
ЬтФПФкШн
ЁОЬтФПЁП![]() ЪЧвЛжжГЃМћЕФЧПбѕЛЏМСЃЌжївЊгУгкЗРИЏЁЂЛЏЙЄЁЂжЦвЉЕШЁЃЯжвдФГжжШэУЬПѓ
ЪЧвЛжжГЃМћЕФЧПбѕЛЏМСЃЌжївЊгУгкЗРИЏЁЂЛЏЙЄЁЂжЦвЉЕШЁЃЯжвдФГжжШэУЬПѓ![]() жївЊГЩЗж
жївЊГЩЗж![]() ЃЌЛЙга
ЃЌЛЙга![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЕШ
ЕШ![]() зїЭбСђМСЃЌЭЈЙ§ШчЯТМђЛЏСїГЬМШЭбГ§ШМУКЮВЦјжаЕФ
зїЭбСђМСЃЌЭЈЙ§ШчЯТМђЛЏСїГЬМШЭбГ§ШМУКЮВЦјжаЕФ![]() ЃЌгжжЦЕУ
ЃЌгжжЦЕУ![]() ЗДгІЬѕМўвбОЪЁТд
ЗДгІЬѕМўвбОЪЁТд![]() ЁЃ
ЁЃ
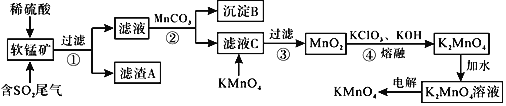
вбжЊЃК![]() ЃЌ
ЃЌ![]() ЛиД№ЯТСаЮЪЬтЃК
ЛиД№ЯТСаЮЪЬтЃК
![]() ТЫдќAЕФГЩЗжЪЧ
ТЫдќAЕФГЩЗжЪЧ![]() аДЛЏбЇЪН
аДЛЏбЇЪН![]() ______ЁЃ
______ЁЃ
![]() ЮіГіГСЕэBЪБЃЌЪзЯШЮіГіЕФЮяжЪЪЧ
ЮіГіГСЕэBЪБЃЌЪзЯШЮіГіЕФЮяжЪЪЧ![]() аДЛЏбЇЪН
аДЛЏбЇЪН![]() ______ЁЃ
______ЁЃ
![]() ВНжш2жаМгШы
ВНжш2жаМгШы![]() ЕФзїгУЮЊ______ЁЃ
ЕФзїгУЮЊ______ЁЃ
![]() ТЫвКCжаМгШы
ТЫвКCжаМгШы![]() ЪБЗЂЩњЗДгІЕФРызгЗНГЬЪНЪЧ______ЁЃ
ЪБЗЂЩњЗДгІЕФРызгЗНГЬЪНЪЧ______ЁЃ
![]() ЭъГЩВНжш4жаЗДгІЕФЛЏбЇЗНГЬЪН______
ЭъГЩВНжш4жаЗДгІЕФЛЏбЇЗНГЬЪН______![]() ______
______![]() ______
______![]() ______
______

![]() ЕчНтжЦБИ
ЕчНтжЦБИ![]() ЕФзАжУШчЭМЫљЪОЁЃЕчНтвКжазюКУбЁдё______РызгНЛЛЛФЄ
ЕФзАжУШчЭМЫљЪОЁЃЕчНтвКжазюКУбЁдё______РызгНЛЛЛФЄ![]() ЬюЁАбєЁБЛђЁАвѕЁБ
ЬюЁАбєЁБЛђЁАвѕЁБ![]() ЁЃЕчНтЪБЃЌбєМЋЕФЕчМЋЗДгІЪНЮЊ______ЁЃ
ЁЃЕчНтЪБЃЌбєМЋЕФЕчМЋЗДгІЪНЮЊ______ЁЃ
ЁОД№АИЁП![]()
![]() ЕїНкШмвКЕФpHЃЌДйНј
ЕїНкШмвКЕФpHЃЌДйНј![]() ЁЂ
ЁЂ![]() ЫЎНтвдГСЕэаЮЪНГ§ШЅ
ЫЎНтвдГСЕэаЮЪНГ§ШЅ ![]() 3 6 3
3 6 3 ![]() бє
бє ![]()
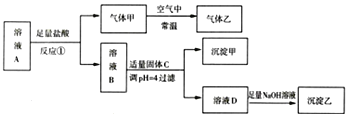
ЁОНтЮіЁП
ЯђШэУЬПѓ![]() жївЊГЩЗж
жївЊГЩЗж![]() ЃЌЛЙга
ЃЌЛЙга![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЕШ
ЕШ![]() ЭЈШыКЌга
ЭЈШыКЌга![]() ЕФЮВЦјЃЌЭЌЪБМгШыЯЁСђЫсЃК
ЕФЮВЦјЃЌЭЌЪБМгШыЯЁСђЫсЃК![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЃЌ
ЃЌ![]() ВЛШмЃЌЙ§ТЫЃЌТЫдќAЮЊ
ВЛШмЃЌЙ§ТЫЃЌТЫдќAЮЊ![]() ЃЌТЫвКжаКЌгаЕФН№ЪєРызгЮЊЃК
ЃЌТЫвКжаКЌгаЕФН№ЪєРызгЮЊЃК![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЃЌМгШы
ЃЌМгШы![]() ЕїНкШмвКЕФpHЃЌДйНј
ЕїНкШмвКЕФpHЃЌДйНј![]() ЁЂ
ЁЂ![]() ЫЎНтвдГСЕэаЮЪНГ§ШЅЃЌГСЕэBЮЊ
ЫЎНтвдГСЕэаЮЪНГ§ШЅЃЌГСЕэBЮЊ![]() КЭ
КЭ![]() ЃЌТЫвКCОЭжївЊКЌга
ЃЌТЫвКCОЭжївЊКЌга![]() ЃЌМгШы
ЃЌМгШы![]() ЪБЗЂЩњМлЬЌЙщжаЗДгІЃК
ЪБЗЂЩњМлЬЌЙщжаЗДгІЃК![]() ЃЌЙ§ТЫЕУЕН
ЃЌЙ§ТЫЕУЕН![]() ЃЌгы
ЃЌгы![]() КЭKOHШлШкЗДгІЃК
КЭKOHШлШкЗДгІЃК![]() ЃЌЕУЕН
ЃЌЕУЕН![]() ЃЌМгЫЎШмвКЕУЕНШмвКЃЌЕчНт
ЃЌМгЫЎШмвКЕУЕНШмвКЃЌЕчНт![]() ШмвКЕУЕНВњЦЗ
ШмвКЕУЕНВњЦЗ![]() ЃЌОнДЫЗжЮізїД№ЁЃ
ЃЌОнДЫЗжЮізїД№ЁЃ
![]() ШэУЬПѓжа
ШэУЬПѓжа![]() ВЛШмгкЫсЃЌЙ§ТЫЃЌТЫдќAЮЊ
ВЛШмгкЫсЃЌЙ§ТЫЃЌТЫдќAЮЊ![]() ЃЛ
ЃЛ
ЙЪД№АИЮЊЃК![]() ЃЛ
ЃЛ
![]() ОЙ§ЗжЮіПЩжЊГСЕэBЮЊ
ОЙ§ЗжЮіПЩжЊГСЕэBЮЊ![]() КЭ
КЭ![]() ЃЌвбжЊЃК
ЃЌвбжЊЃК![]() ЃЌ
ЃЌ![]() ЃЌ
ЃЌ![]() ЕФШмНтЖШИќаЁЃЌЯШГСЕэЃЛ
ЕФШмНтЖШИќаЁЃЌЯШГСЕэЃЛ
ЙЪД№АИЮЊЃК![]() ЃЛ
ЃЛ
![]() ВНжш2жаМгШы
ВНжш2жаМгШы![]() ЕФзїгУЮЊЕїНкШмвКЕФpHЃЌДйНј
ЕФзїгУЮЊЕїНкШмвКЕФpHЃЌДйНј![]() ЁЂ
ЁЂ![]() ЫЎНтвдГСЕэаЮЪНГ§ШЅЃЛ
ЫЎНтвдГСЕэаЮЪНГ§ШЅЃЛ
ЙЪД№АИЮЊЃКЕїНкШмвКЕФpHЃЌДйНј![]() ЁЂ
ЁЂ![]() ЫЎНтвдГСЕэаЮЪНГ§ШЅЃЛ
ЫЎНтвдГСЕэаЮЪНГ§ШЅЃЛ
![]() ТЫвКCжївЊКЌга
ТЫвКCжївЊКЌга![]() ЃЌМгШы
ЃЌМгШы![]() ЪБЗЂЩњМлЬЌЙщжаЗДгІЃК
ЪБЗЂЩњМлЬЌЙщжаЗДгІЃК![]() ЃЛ
ЃЛ
ЙЪД№АИЮЊЃК![]() ЃЛ
ЃЛ
![]() ЭЈЙ§СїГЬПЩжЊВНжш4жаЗДгІЮЊ
ЭЈЙ§СїГЬПЩжЊВНжш4жаЗДгІЮЊ![]() гы
гы![]() КЭKOHШлШкЩњГЩ
КЭKOHШлШкЩњГЩ![]() ЕФЗДгІЃЌЗНГЬЪНЮЊЃК
ЕФЗДгІЃЌЗНГЬЪНЮЊЃК![]() ЃЛ
ЃЛ
ЙЪД№АИЮЊЃК3ЃЛ6ЃЛ3ЃЛ![]() ЃЛ
ЃЛ
![]() бєМЋЮЊ
бєМЋЮЊ![]() ШмвКЃЌбєМЋЪЇШЅЕчзгЗЂЩњбѕЛЏЗДгІЃЌЮЊ
ШмвКЃЌбєМЋЪЇШЅЕчзгЗЂЩњбѕЛЏЗДгІЃЌЮЊ![]() ЃЌЫЕУї
ЃЌЫЕУї![]() дкбєМЋЩњГЩЃЌдђгІЮЊбєРызгНЛЛЛФЄЃЛ
дкбєМЋЩњГЩЃЌдђгІЮЊбєРызгНЛЛЛФЄЃЛ
ЙЪД№АИЮЊЃКбєЃЛ![]() ЁЃ
ЁЃ

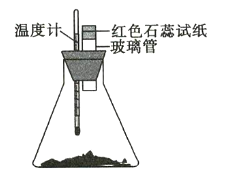
ЁОЬтФПЁПЦћГЕЮВЦјжаКЌгаCOЁЂNOЕШгаКІЦјЬхЁЃ
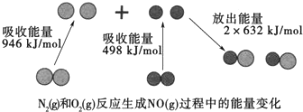
ЃЈ1ЃЉЦћГЕЮВЦјжаNOЩњГЩЙ§ГЬЕФФмСПБфЛЏШчЭМЪОЁЃ1molN2КЭ1molO2ЭъШЋЗДгІЩњГЩNOЛс____ЃЈЬюЁАЮќЪеЁБЛђЁАЗХГіЁБЃЉ____kJФмСПЁЃ
ЃЈ2ЃЉЭЈЙ§NOДЋИаЦїПЩМрВтЦћГЕЮВЦјжаNOЕФКЌСПЃЌЦфЙЄзїдРэШчЭМЫљЪОЃКЃЈЬсЪОЃКO2-ПЩдкДЫЙЬЬхЕчНтжЪжаздгЩвЦЖЏЃЉ
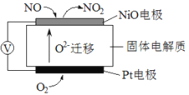
ЂйNiOЕчМЋЩЯЗЂЩњЕФЪЧ___________ЗДгІЃЈЬюЁАбѕЛЏЁБЛђЁАЛЙдЁБЃЉЁЃ
ЂкЭтЕчТЗжаЃЌЕчзгЪЧДг_________ЕчМЋСїГіЃЈЬюЁАNiOЁБЛђЁАPtЁБЃЉЃЎ
ЂлPtЕчМЋЩЯЕФЕчМЋЗДгІЪНЮЊ________________________ЁЃ
ЃЈ3ЃЉвЛжжаТаЭДпЛЏМСгУгкNOКЭCOЕФЗДгІЃК2NO+2CO![]() 2CO2+N2ЁЃвбжЊдіДѓДпЛЏМСЕФБШБэУцЛ§ПЩЬсИпИУЗДгІЫйТЪЃЌЮЊСЫбщжЄЮТЖШЁЂДпЛЏМСЕФБШБэУцЛ§ЖдЛЏбЇЗДгІЫйТЪЕФгАЯьЙцТЩЃЌФГЭЌбЇЩшМЦСЫШ§зщЪЕбщЃЌВПЗжЬѕМўвбОЬюдкЯТБэжаЁЃ
2CO2+N2ЁЃвбжЊдіДѓДпЛЏМСЕФБШБэУцЛ§ПЩЬсИпИУЗДгІЫйТЪЃЌЮЊСЫбщжЄЮТЖШЁЂДпЛЏМСЕФБШБэУцЛ§ЖдЛЏбЇЗДгІЫйТЪЕФгАЯьЙцТЩЃЌФГЭЌбЇЩшМЦСЫШ§зщЪЕбщЃЌВПЗжЬѕМўвбОЬюдкЯТБэжаЁЃ
ЪЕбщБрКХ | tЃЈЁцЃЉ | NOГѕЪМХЈЖШ ЃЈmol/LЃЉ | COГѕЪМХЈЖШЃЈmol/LЃЉ | ДпЛЏМСЕФБШБэУцЛ§ЃЈm2/gЃЉ |
Ђё | 280 | 1.2ЁС10Љ3 | 5.80ЁС10Љ3 | 82 |
Ђђ | 280 | 1.2ЁС10Љ3 | b | 124 |
Ђѓ | 350 | a | 5.80ЁС10Љ3 | 82 |
ЂйЧыНЋБэжаЪ§ОнВЙГфЭъећЃКa ___________ЁЃ
ЂкФмбщжЄЮТЖШЖдЛЏбЇЗДгІЫйТЪЙцТЩЕФЪЧЪЕбщ____________ЃЈЬюЪЕбщађКХЃЉЁЃ
ЂлЪЕбщЂёКЭЪЕбщЂђжаЃЌNOЕФЮяжЪЕФСПХЈЖШcЃЈNOЃЉЫцЪБМфtЕФБфЛЏЧњЯпШчЭМЫљЪОЃЌЦфжаБэЪОЪЕбщЂђЕФЪЧЧњЯп_______ЃЈЬюЁАМзЁБЛђЁАввЁБЃЉЁЃ
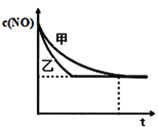
ЃЈ4ЃЉдкШнЛ§ЙЬЖЈЕФОјШШШнЦїжаЗЂЩњЗДгІ2NO+2CO![]() 2CO2+N2ЃЌВЛФмЫЕУївбДяЕНЦНКтзДЬЌЕФЪЧ________ЃЈВЛЖЈЯюбЁдёЃЉЃЛ
2CO2+N2ЃЌВЛФмЫЕУївбДяЕНЦНКтзДЬЌЕФЪЧ________ЃЈВЛЖЈЯюбЁдёЃЉЃЛ
AЃЎШнЦїФкЛьКЯЦјЬхЮТЖШВЛдйБфЛЏ BЃЎШнЦїФкЕФЦјЬхбЙЧПБЃГжВЛБф
CЃЎ2ІдФц(NO)=Іде§(N2) DЃЎШнЦїФкЛьКЯЦјЬхУмЖШБЃГжВЛБф