��Ŀ����
����Ŀ��Na2CO3��һ�ֺ���Ҫ�Ļ�ѧ������ijѧ������ʵ�������Ʊ�Na2CO3�������������Ʊ�ʵ����̣�
��50mL NaOH��Һ����CO2���壬�Ʊ�Na2CO3��Һ��Ϊ�˷�ֹͨ���CO2�������������NaHCO3�������������ʵ�鲽�裺(I)��25mL NaOH��Һ���չ�����CO2���壬��CO2���岻���ܽ⣻(II)С�������Һ1��2���ӣ�(III)�ڵõ�����Һ�м�����һ��(25mL)NaOH��Һ��ʹ��Һ��ֻ�ϡ�
(1)(II)�������Һ��Ŀ���� ��
(III)�л����һ��NaOH��Һ�����ķ�Ӧ�� ��(д���ӷ���ʽ)
(2)����ͬѧ����ƣ���(I)��ʵ��װ�����£�
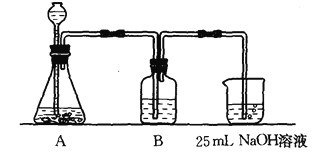
��װ��Aʹ�õ��Լ��� (����)�� ��Һ��
��װ��Bʹ�õ��Լ������ (ѡ��ˮ������NaOH��Һ������Na2CO3��Һ������NaHCO3��Һ)�������� ��д��B�п��ܷ��������ӷ���ʽ ���������Bװ�ã����յõ���Na2CO3��Һ�п��ܴ��ڵ������� ��
��������Ϊʵ�鲽��(II)��(III)��˳��Ե������Ȼ�ϣ�����У�������������Ϊ (���������������)��ԭ��Ϊ ��
���𰸡�(1)��ȥ����������CO2��������ֹ̼�����Ʒֽ⡣
OH-+HCO3-=CO32-+H2O
(2)��ʯ��ʯ ����������̼��������Һ
��ȥCO2�����л��е�HCl���� H++HCO3-=CO2��+H2O
NaCl NaOH
������ �����Ķ�����̼�����������Ʒ�Ӧ����̼������,���²��ﲻ��
��������
���������(1)��(��)�������Һ��Ŀ���Ǹ����ܽ�����Һ�е�CO2���壬��ֹ̼�����Ʒֽ⣬������������Һ���ܽ��CO2���壬����(��)�����NaOH���в�����CO2��Ӧ�����ĵ���ʹNaHCO3������ȫת����Na2CO3����(��)�л����һ��NaOH��Һ�����ķ�Ӧ�����ӷ���ʽ��̼�������ܺ��������Ʒ�Ӧ����̼���ƺ�ˮ����Ӧ���ӷ���ʽΪHCO3-+OH-�TCO32-+H2O��
(2)���Ʊ�������̼������Լ�ѡ��Ӧԭ���ǹ���̼��ƺ����ᷴӦ���ɶ�����̼���壬ѡ�����Ϊ����ʯ��ʯ��ʯ��Һ��Ϊ���
���÷�Ӧ�Ƿ��ȷ�Ӧ�����ŷ�Ӧ�Ľ��У���Һ���¶����ߣ�������лӷ��ԣ��������ɵĶ�����̼�к����Ȼ������壬Ϊ�˳�ȥ������̼�е��Ȼ��������ֲ������µ����ʣ��ñ��͵�̼��������Һ�����Ȼ��⣬��ʱ������Ӧ�����ӷ���ʽΪ H++ HCO3-= CO2��+H2O����ȥ��װ��B���Ȼ���Ͷ�����ֱ̼�ӽ�������������Һ�У��������Ȼ��ƣ�̼���ƣ��ټ�����������������Һ���������ƻ���������Ժ��е�������ҪΪNaCl��NaOH��
�����ʵ�鲽��(II)��(III)��˳��Ե�����Һ���ܽ��˲��ֶ�����̼��������̼���������Ʒ�Ӧ��ʹ�������Ƶ������٣����Һ��̼�����ƺ��������Ƶ����ʵ�������ȣ����Բ���ǡ����ȫ��Ӧ����̼���ƣ������̼�����ƣ����Բ�������

 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д� �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�