题目内容
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A.1 mol / L甲酸溶液的c(H+)="0.01" mol/L |
| B.甲酸能与水以任何比例互溶 |
| C.10 mL 1 mol/L甲酸恰好与10 mL 1 mol/L NaOH溶液完全反应 |
| D.甲酸溶液的导电性比盐酸的弱 |
A
解析

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知:AgI为黄色沉淀,AgCl为白色沉淀。25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol·L-1;AgCI饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5 mL含有KC1和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL0.0l mol·L-1的AgNO3溶液,则下列叙述中不正确的是
| A.溶液中所含溶质的离子浓度大小关系为c(K+)>c(NO3-)>c(Cl-)>c(I-)>c(Ag+) |
| B.溶液中先产生的是AgI沉淀 |
| C.AgCl的KSP的数值为1.69×10-10 |
| D.若在AgI悬浊液中滴加一定量的KCl溶液,黄色沉淀也会转变成白色沉淀 |
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )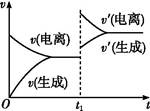
| A.加少量烧碱溶液 | B.升高温度 | C.加少量冰醋酸 | D.加水 |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于难溶物之间转化的说法中错误的是( )
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于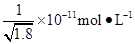 |
下列说法正确的是( )
| A.25 ℃时NH4Cl溶液的Kw大于100 ℃时NaCl溶液的Kw |
| B.SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O====SO32―+2I―+4H+ |
| C.加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2―、NO3- |
| D.100 ℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:
①NaCN+HNO2=HCN+NaNO2,
②NaCN+HF=HCN+NaF,
③NaNO2+HF=HNO2+NaF。
由此可判断下列叙述中,不正确的是( )
| A.HF的电离平衡常数为7.2×10-4 |
| B.HNO2的电离平衡常数为4.9×10-10 |
| C.根据①③两个反应即可知三种酸的相对强弱 |
| D.HNO2的电离平衡常数比HCN大,比HF小 |
下列叙述不正确的是 ( )。
| A.图a中,曲线Ⅱ表示醋酸溶液加100 mL水稀释的图像 |
| B.图b中,可能各投入的锌粒颗粒大小相同且质量均为0.65 g |
| C.图c中,在①、②、③、④、⑤各点的溶液中所含阴离子种类不同 |
| D.图d中,三个不同温度中,313 K时Ksp(SrSO4)最大;且283 K时,图中a点对应的溶液是不饱和溶液 |
常温下,向20 mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )。
| A.a与b之间的溶液中只存在:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.b与c之间的溶液中不存在:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| C.b点时,V(NaOH溶液)=20 mL,且c(CH3COO-)=c(Na+) |
D.a、b、c点表示的溶液中 均相等 均相等 |