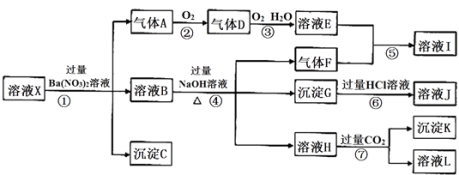
题目内容
【题目】下列图示与对应的叙述一定正确的是( ) 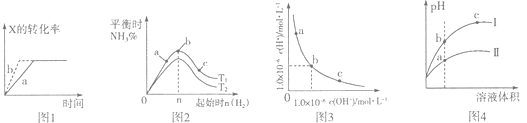
A.图l所示,反应:X(g)+2Y(g)═3Z(g),b的压强一定比a大
B.图2表示合成氨反应,温度T1和T2对应的平衡常数为K1、K2 , 则:T1<T2 , K1>K2
C.图3表明,该温度下,加入FeCl3不可能引起由b向a的变化
D.图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a
【答案】B
【解析】解:A、图1所示反应:X(g)+2Y(g)3Z(g),b曲线表示的可以是增大压强,还可能是使用催化剂,故A错误;
B、合成氨的反应为放热反应,温度越高,平衡左移,氨气的百分含量越小,根据图象可知,温度T1<T2 , 而氨气的百分含量越高,说明平衡向右进行的程度越大,则K值越大,故有:K1>K2 , 故B正确;
C、温度不变,Kw不变,而氯化铁溶于水后水解显酸性,故氯化铁溶于水后溶液中的c(H+)变大,而c(OH﹣)变小,即可以由a转化为b点,故C错误;
D、图象分析,醋酸是弱电解质存在电离平衡,稀释相同倍数,强酸pH变化大,Ⅰ表示盐酸,Ⅱ表示醋酸,导电性a>b>c,故D错误.
故选B.
【考点精析】本题主要考查了化学平衡状态本质及特征和弱电解质在水溶液中的电离平衡的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.